Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 91
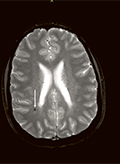
[1-es típusú cerebralis cavernosus malformatio retinaér-tortuositassal és KRIT1 gén mutációval]
[A cerebralis cavernosus malformatiók (CCM) viszonylag ritka és heterogén klinikai entitást képviselnek; a háttérben három génben találtak eddig mutációkat. Sporadikus és öröklődő formáit is leírták. Itt egy fiatal nőbeteg esetét mutatjuk be, aki epizodikus paraesthesia és fejfájás panaszával jelentkezett, de akut neurológiai tünetek nem voltak. ]
Új lehetőségek a tüdőrák kezelésében
Az utóbbi években az onkológia területén hatalmas kutatás folyik és ennek eredményeként lényegesen hosszabb túlélést láthatunk az orvoslás ezen területén. A tüdőrák, ha nem is vált gyógyítható betegséggé, kezd a krónikus betegségek családjába tartozni. Mind a sebészeti bravúrok, mind a sztereotaxiás radioterápia és a gyógyszeres kezelésben bekövetkezett változások eredményeként ma már az áttétes tüdődaganatos betegcsoportban sem ritka az ötéves túlélés, relatíve hosszú progresszióig eltelt idő mellett. Nagy túlélési előnyt jelentett a korábbi, harmadik generációs citotoxikus kombinációk után a hozzáadott, érnövekedés- gátló (VEGF-gátló) maintenance kezelés vagy a folyamatos pemetrexed citotoxikus kemoterápia. Az első igazi áttörést, a hosszú progressziómentes túlélést a célzott kezelés hozta, amely ismert driver mutációk mellett bizonyult hatékonynak. A másik nagy eredményt, különösen az éveken át „mostoha” laphámsejtes karcinómánál, az immunterápia, az immunellenőrző pontok gátlása jelentette, amelynek hatékonysága adenocarcinomában is igazolódott. Számos kutatás folyik az immunterápia adjuváns, neoadjuváns, valamint kombinált alkalmazásával (akár sugárterápiával, akár citotoxikus kemoterápiával kombinálva).
Az áttétes colorectalis rák molekuláris altípusai és a terápiás döntések fejlődése
A colorectalis ráknak (CRC) klinikailag igen jelentős molekuláris heterogenitása van, amely különböző szinteken jelentkezik: a genomikában, az epigenomikában, a transzkripcióban és a mikrokörnyezetben. A karcinogenezis során szerzett genomikus történések hajtják („drive”) áttétes helyzetben a rák progresszióját. Például a KRAS- és az NRAS-mutációk jelzik azokat a daganatsejt-populációkat, amelyek refrakterek az EGFR monoklonális antitestekre, a BRAFV600E-mutációt hordozók viszont rosszabb kimenetelre számíthatnak a standard kezelések és a kombinált célzott kezelések mellett, míg a HER2-amplifi káció arra utal, hogy a daganat különlegesen érzékeny egy kettős HER2-blokáddal szemben. A többszörös, ritka géneltérések által hajtott EGFR monoklonális antitestek elleni rezisztencia jelentős átfedésben van a primer, valamint a szerzett rezisztencia mechanizmusában a klónszelekciós folyamat során. Ebben a tekintetben refrakter esetekben a keringő tumor-DNS szekvenciális vizsgálata vezethet gyógyszerek kifejlesztéséhez. A ritka kinázfúziós események és a DNS-károsodás utáni repair-ben részt vevő gének komplex eltéréseit is leírták, amelyek a célzott kezelések targetjei lehetnek. Másrészt a transzkripció szubtípusai és a jelátviteli utak aktivációs jelei szintén prognosztikai és potenciálisan prediktív értékkel bírnak áttétes colorectalis rákban. Ezek a jelek a stromalis sejtek és az immunkörnyezeti sejtek, valamint a daganatsejtek közötti interakciókat jelzik. Például a mikroszatellita-instabilitást mutató (MSI) vagy a POLE ultramutáns CRC-daganatsejtek különlegesen érzékenyek az immunellenőrzőpont-gátlókra, míg az olyan mesenchymalis fenotípusú daganatok, amelyeket az immunszuppresszív molekulák aktivációja jellemez, jó tárgyai lehetnek egy új immunterápiás kombináció kialakítására. Ebben a cikkben átnézzük az áttétes CRC-ben kimutatott, célzott terápiára alkalmas onkogéneltéréseket és -szignatúrákat, valamint tárgyaljuk az új molekuláris diagnosztikus próbák klinikai alkalmazásának lehetőségeit.
p53 – A szuppresszor
A szervezet működésének egyik feltétele, hogy annyi sejt keletkezzen, pusztuljon el, hogy a sejt a funkcióit megfelelően el tudja látni. Úgy, hogy genetikai, örökölt vagy szerzett génhiba ne kerüljön át az utódsejtekbe! Erről gondoskodik a p53 vezette DNS-hiba-javító rendszer. Ha ez nem sikerül, akkor a hibák továbbjuthatnak a következő generációba, aminek olyan következményei lehetnek, mint a génszintű szabályozás instabillá válása, a tumorkialakulás rizikójának növekedése. A p53-nak az a feladata, hogy szükség esetén aktiválja a hibajavítókat és amennyiben ez csődöt mond, akkor az apoptózis mechanizmusát. Normális körülmények esetén ezért kulcsszereplő a p53. Azonban a p53-nak is lehetnek hibái, különböző mutációk, amelyekről feltételezték, hogy terápiás célpontok lehetnek, de ezt klinikai szinten egyelőre még nem sikerült igazolni.
Papillorenalis szindróma: a PAX2 békétlen mutációi
Az autoszomális domináns papillorenalis szindróma a PAX2 gén döntően de novo mutációinak következménye. A PAX2 egy transzkripciós faktort kódol, amely főként a vese, a húgyutak, az idegrendszer, a szem és a fül szöveteiben expresszálódik. Haploinsufficientiájának következtében a vese jellemzően hypoplasiás és hiperreflektív, de kialakulhat más fejlődési rendellenessége is. A klinikai megjelenést dominálhatja a nephroticus proteinuria, szövettanilag fokális szegmentális glomerulosclerosissal. Az okozott veseérintettség súlyossága rendkívül változó, a felismert esetek nagy részében az első négy évtizedben vezet végstádiumú veseelégtelenséghez. A PAX2-mutációk jellegzetes látóidegfő-eltérésekhez vezetnek, amelyek közül a leggyakoribb a látóidegfő (papilla) dysplasiája. A szindróma nevét meghazudtolva a PAX2-mutációt hordozó betegek negyedében nem alakul ki szemérintettség. Halláskárosodás ritkán, az esetek kevesebb mint 10%-ában társul. Az általunk azonosított öt családban az érintettek a másodiknegyedik évtizedben szorultak vesepótló kezelésre, teljes funkció vesztést okozó mutációk következtében.
Hírvilág
2018. OKTÓBER 04.
A beteg dolga az, hogy panaszkodjon
A Magyar Onkohematológiai Betegekért Alapítvány (MOHA) 2016 óta minden ősszel Mieloproliferatív Információs Napot szervez, melynek fókuszában a mieloproliferatív betegségek, a policitémia véra, a mielofibrózis és az esszenciális trombocitémia állnak. A rendezvény célja, hogy az érintettek hiteles forrásból tájékozódhassanak betegségükről és a kezelési lehetőségekről. Az eseményt követő séta a Szabadság hídon a piros esernyőkkel arra hívja fel a figyelmet, hogy a korszerű kezelésekkel ma már van arra lehetőség, hogy a betegek megszabaduljanak a mindennapjaikat megterhelő tünetektől.
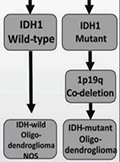
[Az izocitrát-dehidrogenáz-mutációk szerepe a glioblastoma biológiájában és a terápiás döntéshozatalban]
[Az onkogenezis sorozatos szomatikus mutációk felhalmozódásához köthető. Számos daganat esetében megtörtént a genomikai háttér átfogó elemzése, és a glioblastoma az elsők között volt.]
Hírvilág
2018. FEBRUÁR 06.
A számítógépes biológiai képelemzésről szerveztek nemzetközi konferenciát Szegeden
Mintegy 250 biológus, képelemzéssel foglalkozó informatikus, valamint mikroszkópok építésével foglalkozó szakember részvételével szerveztek nemzetközi konferenciát a Magyar Tudományos Akadémia Szegedi Biológiai Kutatóközpontjában.
MEK és ERK - RAS és RAF ellen
A célzott terápia kezdeti klinikai hatása után a legtöbb esetben a tumor rezisztenssé válik a kezeléssel szemben, aminek megfordítása jelenleg az egyik legnagyobb probléma a klinikai onkológiai gyakorlatban. Ennek a szekunder rezisztenciának sok oka lehet, pl. új driver mutáció jelenik meg a kezelt tumorban, az eredeti célponttól eltérő hibát tartalmazó klón lesz a meghatározó, a tumorsejtek funkcióinak, elsősorban proliferációjának szabályozását egy másik jelút veszi át. (Az sem közömbös, hogy a célzott terápiára lokálisan előrehaladt és/vagy metasztatikus tumorok esetében kerül sor.) Ilyen változások igen gyakoriak a RAS-RAF-MEK-ERK jelátviteli úton. A zavarokat főleg mutációk okozzák, és vezetnek a tumorsejtek korlátlan szaporodásához, terjedéséhez. Az egyik kulcsproblémát a RAS mutációi jelentik, amelyek befolyásolása ma még megoldatlan. A leggyakoribb BRAF leggyakoribb mutációját gátlószerekkel sikerült átmeneti klinikai választ elérni, főleg melanomákon. Felmerült, hogy a kóros jelátvitel megakadályozását a jelúton a MEK és/vagy ERK gátlásával lehetne elérni, hiszen ezek aktivitása a fenti hibák miatt fokozottá válik. Ezek a próbálkozások a logikus elgondolás ellenére áttörő sikert még nem értek el. Ez az összefoglaló elsősorban a MEK-kel kapcsolatos eredményeket, a további lehetőségeket tekinti át.
A random variancia mint karcinogén tényező?
Egyes ráktípusoknál egy eddig nem tárgyalt, független tényező is hozzájárulhat a rák megjelenéséhez — mégpedig a DNS osztódása során megjelenő véletlenszerű hibák okozta mutációk, a random variancia hatása.
1.
2.
3.
4.
5.
1.
2.
3.
Ideggyógyászati Szemle
[Visszatérő, egyidejű központi idegrendszeri demyelinisatio perifériás demyelinisatióval/nodopathiával – egy szeronegatív beteg esete]4.
5.