Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Terápiás területek
Immunonkológia
Az idős beteg és a bőronkológia: fókuszban a szűrés jelentősége
Az időskori mortalitásban és morbiditásban a rosszindulatú bőrdaganatok fontos szerepet játszanak. Időben történő felismerésük és korai ellátásukkal megelőzhetők a későbbi szövődmények. Rendszeres szűrővizsgálattal és a nem bőrgyógyászati szakképzettségű egészségügyi személyzet edukációjával a korai felismerés aránya jelentős mértékben javítható.
Az onkológiai terápia alkalmazása idős betegek esetében
Az idős daganatos betegek onkológiai kezelése során kiemelten fontos a fiziológiás változások, a tünetek, a panaszok és a társbetegségek figyelembevétele. A daganat okozta panaszokat és tüneteket a komorbiditási tényezők sokszor elfedhetik, ami gyakran késleltetett diagnózishoz vezet. Ebben az életkorban a reszekábilis daganat is sokszor a beteg státusza miatt inoperábilissá válik, továbbá műthetőség esetén a betegek korával nő a szövődmények aránya és a halálozás gyakorisága.
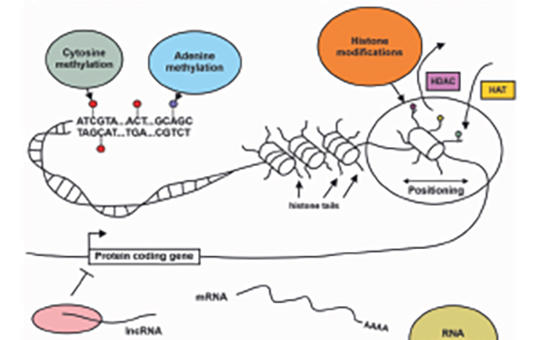
[A glioblastoma-epigenomika komplex biológiai folyamatokat és potenciális terápiás célpontokat tár fel]
[Az agydaganat legsúlyosabb típusát, a glioblastomát (GBM) mélyrehatóan tanulmányozták OMICS-módszerekkel az elmúlt években, és legjellegzetesebb molekuláris meghatározói a kórszövettani diagnózis részévé váltak. A kutatási ismeretek azonban csak részben kerültek át a klinikai gyakorlatba. Jelen tanulmányunk célja, hogy epigenomikai elemzéseink eredményei alapján bemutassuk a GBM korai és késői molekuláris meghatározóit a gyakorló szakemberek számára.
A GBM-mintákat az első diagnózis után (GBM1) és kiújuláskor (GBM2) nyertük sebészeti úton. A DNS-t 24 pár formalinnal fixált, paraffinba ágyazott daganatszövetből vontuk ki. A könyvtárkészítés a Reduced Representation Bisulfite Sequencing kit alkalmazásával történt. A könyvtárakat egy Illumina NextSeq 550 készüléken szekvenáltuk. A metilációs kontrollokat (MC) egy nyilvánosan elérhető adatbázisból nyertük. Bioinformatikai elemzéseink során azonosítottuk a differenciálisan metilált útvonalakat és azok elemeit az MC-, GBM1- és GBM2-csoportokban.
Számos differenciáltan metilált útvonalat találtunk a GBM1 vs. MC és a GBM2 vs. MC összehasonlítások során, amelyek intracelluláris biológiai és agyszövet-fejlődési folyamatokban vesznek részt. Ezzel szemben, a GBM2 vs. GBM1 differenciáltan metilált útvonalai közül az immunszabályozásban, a neurotranszmitter- (különösen a dopaminerg, noradrenerg és glutaminerg) válaszokban, valamint az őssejt-differenciálódás és -proliferáció szabályozásában részt vevő útvonalak emelhetők ki.
Elemzésünk a korai és késői gliomagenezis biológiai komplexitását tárta fel, ami az alapvető biológiai elemektől az eltorzult idegfejlődési folyamatokon át a tumor-mikrokörnyezet specifikusabb immun- és neurotranszmitter-folyamatáig terjed. Ezek az eredmények célpontokat jelölnek meg új terápiás megközelítések számára.]
Mentális egészségügyi eredmények idősebb emlőráktúlélőknél: ötéves utánkövetés a CLIMB tanulmányból
Az emlőrák a leggyakrabban diagnosztizált malignus betegség a nők körében, és a betegek több mint 30%-a a diagnózis megállapításakor 70 év felett van. A túlélő emlőrákos nők mentális egészségéről még kevés kutatási adat áll rendelkezésre, ezért a szemlézett tanulmány szerzői felmérték a diagnózist követő első öt évben tapasztalható depressziós tünetek, a magányosság és az apátia mértékét.
A multidiszciplináris szakdolgozói team szerepe az idős daganatos betegek ellátásában
Az idősek aránya világszerte, így Magyarországon is folyamatos emelkedést mutat. A 2022-ben tartott népszámlálás alapján a 65 éven felüliek aránya elérte a 20,6%-ot. Az idős betegekre jellemző a mutimorbiditás. Az idős emberek közel fele három vagy több idült társbetegségben szenved. A multimorbid betegek funkcionális hanyatlást rosszabb életminőséget mutatnak, nagyobb a mortalitásuk.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.