Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 259
A petefészekrák kezelésének frontvonalában: a PARP-gátlók szerepének megújítása
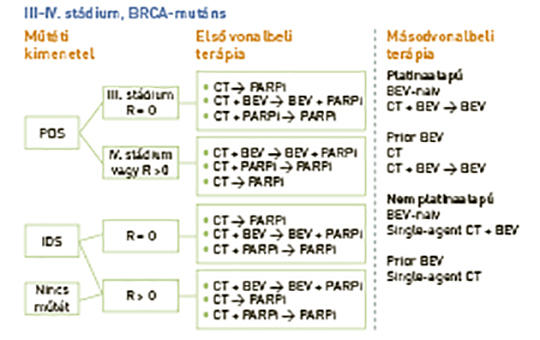
Kiújult petefészekrákban a poli(ADP-ribóz)polimeráz- (PARP-) gátlókkal történő kezelések megváltoztatták a platinaérzékeny daganatok kezelését. Az új adatok szerint a PARP-gátlókat a kezelési algoritmus korábbi szakaszában kell alkalmazni. A kutatók számba veszik azokat a fázis III vizsgálatokat, amelyekben a PARP-gátlók hatását értékelték újonnan diagnosztizált petefészekrákok primer, illetve fenntartó kezelésében. Megvitatják a gyógyszerek hatásosságát és biztonságosságát az összes daganat, illetve a biomarkerek szerint válogatott daganatok klinikai vizsgálataiban, és összevetik a különböző vizsgálatok előnyeit és korlátait. Fontolóra veszik a jövő kutatásainak prioritásait – különös tekintettel a betegek kiválasztására és a jövőben alkalmazandó, egyelőre hiányzó gyógyszeres regimenek megalkotására. Négy fázis III vizsgálatban (SOLO-1, PAOLA-1/ENGOT-OV25, PRIMA/ENGOT-OV26 és VELIA/GOG-3005) PARP-gátlók használatával (olaparib, niraparib vagy veliparib) a progressziómentes túlélés jelentős javulását figyelték meg petefészekrákos betegekben. A vizsgálatok eltérő kialakítása (kezelés vagy fenntartó kezelés, egy gyógyszeres vagy kombinációs kezelés, bevacizumabbal vagy bevacizumab nélkül), a betegek kiválasztása (műtéti eredmény, biomarkerek elérhetősége, prognózis szerint), a résztvevők eredeti megválasztása (intention-to-treat, BRCA-mutációs vagy homológ rekombinációdeficites pozitív) befolyásolták a vizsgálatokból levonható következtetéseket. A teljes túlélési adatok még függőben vannak, hosszú távú biztonságossági adatok is csak korlátozottan állnak rendelkezésre. A PARP-gátlók sarkalatos szerepet játszanak az újonnan kimutatott petefészekrák-ellátásban, és befolyásolják a további kezeléseket. Ki kell választani azokat a betegeket és gyógyszereket, akiknél az eddigi alkalmazott kezelések a PARP-gátlóknál kevesebb haszonnal járnának.
Heterogenitás és a daganatok
A sejtek alapvető feladata, hogy fenntartsák az egyensúlyt a proliferáció és a programozott sejthalál között, amely lehetőséget ad a sejt számára, hogy specifikus feladatát végrehajtsa. Ez a folyamat szorosan összekapcsolódik a szomszédos sejtekkel, továbbá a sejtek közötti állománnyal is. Mindezek szabályozásában hibák keletkezhetnek, persze leggyakrabban mutációk. Ezek némelyike a sejt életében zavarokat okozhat, azonban a mutációk többsége nem játszik fontos szerepet. Jól ismert a benignitás és a malignitás elkülönítése, amelyből a daganatsejtek metasztatizálása az igazi veszély. (Tulajdonképpen klinikailag akkor lehet malignusnak tekinteni egy daganatot, ha képes a metasztatizálásra.) Ez az említett hiba lehet veleszületett és szerzett, amellyel a normális klonális jelenlétet fokozatosan uniklonálissá változtatja (inkább a hematológiai tumorokban, mintsem a szolidokban), és ez a poliklonalitás összezavarja a sejt funkcionális képességét. Érthető tehát, hogy ezt a két jelenséget, a metasztatizálást és a szelekciót tekinthetjük a terápia első számú célpontjának. A heterogenitás fontos szerepet játszik a sejtek életében.
Mammográfiás szűrésre várják október 30-án a beutalóval rendelkező hölgyeket az SZTE Radiológiai Klinikán
A mellrák a hölgyek körében a leggyakrabban előforduló daganattípus, amely világszerte a nők 10-12 százalékát érinti, és évente mintegy 2200 életet követel Magyarországon! Ennek oka, hogy a többségüknél már csak előrehaladott klinikai stádiumban ismerik fel a betegséget, miközben az időben felfedezett és diagnosztizált emlődaganat sokkal hatékonyabban gyógyítható! Mivel a betegség kezdeti stádiumában tünet- és panaszmentes, ezért nem lehet elégszer hangsúlyozni a szűrővizsgálatok és a helyesen végzett, rendszeres önvizsgálat fontosságát! A legközelebbi mammográfiás szűrőnapon, október 30-án, pénteken 15 órától 20 óráig várják az SZTE Radiológiai Klinika Női Diagnosztikai Osztályán a beutalóval rendelkező hölgyeket szűrővizsgálatra.
Az inváziós spektrum prognosztikai jelentősége glioblastomában
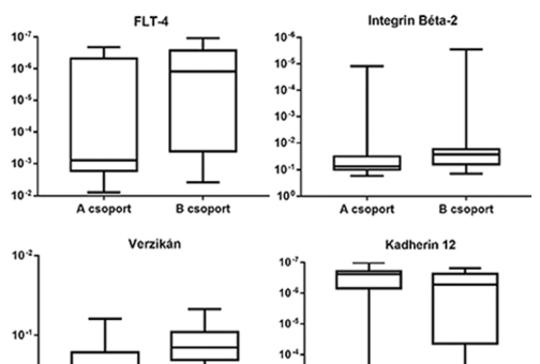
A glioblastoma a leggyakoribb központi idegrendszeri rosszindulatú daganat; sebészi kezelése a daganatok invazív jellegénél fogva nem lehetséges, onkoterápiája pedig csupán szerény eredményeket hoz – a betegek átlagos teljes túlélése (OS) 16–24 hónap. A betegek egy része alig reagál az alkalmazott kezelésre; a klinikumban jelenleg nincs olyan prognosztikai vagy prediktív marker, ami segítené a betegek túlélésében tapasztalható jelentős szórás érdemi feltérképezését és a kezelési algoritmus optimalizálását. Jelen kutatásban az invázióban szerepet játszó extracelluláris mátrix (ECM-) molekulák expressziójának prognosztikai jelentőségét kívántuk meghatározni. Eltérő prognózisú betegcsoportokat létrehozva (A csoport OS < 16 hónap, B csoport OS > 16 hónap) vizsgáltuk meg glioblastomás betegek gyorsfagyasztott tumormintáiban a szakirodalom által jelenleg elismert markerek (IDH1 mutációs és MGMT metilációs státusz) jelenlétét, továbbá 46 inváziós ECM-molekula mRNS-szintjét. A DE KK Idegsebészeti Klinikán operált és az Onkológiai Klinikán utókezelt betegek klinikai adatai nem mutattak jelentős különbségeket a túlélési adatokat (progressziómentes és teljes túlélés) és a reoperációs arányt leszámítva. Minden minta IDH vad típusú volt. Jelentős különbség volt a jobb és a rosszabb túlélésű betegek között az MGMT promoter hipermetiláció arányában (28,6% vs. 68,8%). Az inváziós ECM-molekulák expressziós mintázata, az inváziós spektrum szintén jelentős különbséget mutatott; szignifikáns különbség mutatkozott az integrin β2, kadherin-12, FLT4/VEGFR-3, verzikán molekulák expressziójában. Az inváziós spektrum megbízhatóságát statisztikai osztályozóval tesztelve a módszer a minták 83,3%-át sorolta a megfelelő prognosztikai csoportba (PPÉ: 0,93). A különböző túlélésű betegcsoportok összehasonlítása során a reoperációs arányban megfigyelhető különbség az irodalmi adatokkal összevágó tény. Az MGMT promoter metiláltságának vizsgálata hazai újdonság, az eredmény az eddigi ismereteket megerősítve sürgeti a vizsgálat rutinszerű bevezetését. Az inváziós spektrum vizsgálata többletinformációt ad a tumorról, prognosztikai markerként segíthet felismerni az agresszívabb tumorokat, továbbá felhívja a figyelmet az antiinvazív ágensek jövőbeni használatának szükségességére a GBM terápiájában.
A Magyar Hypertonia Társaság, a Magyar Nephrologiai Társaság és a Magyar Reumatológusok Egyesületének konszenzusdokumentuma - A hyperurikaemiás és a köszvényes betegek ellátásáról
Ez a konszenzusdokumentum azért született, hogy iránymutatást adjon a magas húgysavszinttel élő tünetmentes személyek, illetve a köszvényes betegek hatékony és modern szemléletű ellátásához. A dokumentumot három hazai tudományos társaság, a Magyar Hypertonia Társaság, a Magyar Nephrologiai Társaság és a Magyar Reumatológusok Egyesületének szakértői testülete állította össze annak érdekében, hogy összefoglalják mindazokat az ismereteket, amelyek jelenleg rendelkezésünkre állnak a kérdésben. Emellett a konszenzusdokumentum megalkotásának fontos célkitűzése volt olyan egyértelmű ajánlások megfogalmazása, amelyek segítenek a gyakorló orvosnak a hyperurikaemiás és a köszvényes betegek mindennapi ellátásában.
A késői kezdetű Pompe-kórban szenvedők enzimpótló kezelésének hosszú távú követése
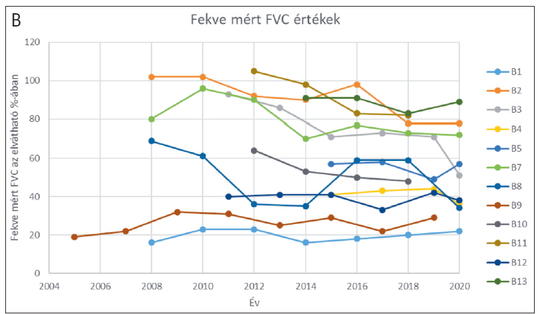
A Pompe-kór (PD) egy ritka lizoszomális tárolási betegség, amit a GAA gén mutációja következtében kialakuló α-glükozidáz (GAA) enzim elégtelen működése okoz. Az enzimdeficientia a glikogén lizoszomális felszaporodásához vezet. A betegségnek két klinikai formája ismert, az újszülöttkori, valamint a késői forma. Jelenleg a betegség hátterében a GAA génnek közel 600 mutációja ismert. A kaukázusi populációban a késői forma hátterében a c.-32-13T>G mutáció a leggyakoribb, az allélfrekvencia közel 70%. A Pompe-kórt enzimpótló terápiával (ERT) tudjuk kezelni, kéthetente Myozyme infúzió adásával. Közleményünkben 13, több mint öt éve kezelt, késői kezdetű formában szenvedő beteg hosszú távú követését mutatjuk be. A leghosszabb követési idő 15 év volt. A kezelés eredményességének megítélésére évente mértük a 6 perces járótávolságot és a légzésfunkciót. Az adatok alapján a 6 perces járótávolság az enzimpótló kezelés indítása után körülbelül 3-4 évig javult, ezt követően az esetek többségében a megtett távolság csökkent. A több mint 10 éves követés után a kezdeti 6 perces járótávolsághoz képest romlást tapasztaltunk az esetek 77%-ában, javulást az esetek 23%-ában. A követés ideje alatt mindössze egyetlen beteg került kerekesszékbe. A légzésfunkció, különösen fekvő helyzetben hasonlóan alakult. A betegek terápiára adott válaszában nagy variabilitást figyeltünk meg, ami csak részben mutatott összefüggést a terápiás fehérje ellen termelődő antitestszinttel. Az ERT eredményessége jelentősen függött a betegséget okozó mutáció típusától, a betegség státuszától a kezelés kezdetekor, a beteg fizikai aktivitásától és táplálkozási szokásaitól. Az innovatív orphan gyógyszerekkel kezelt betegek hosszú távú követése kiemelkedően fontos ahhoz, hogy megismerjük a kezelés valós hasznát és a betegek igényeit.
A biológiai óra és a daganatok
Jelen összefoglalásban képet adunk a biológiai ritmusok közül a cirkadián ritmusról, annak szabályozásáról és a tumorgenezissel való kapcsolatáról. Cirkadián ritmusnak nevezzük azt a biokémiai, fiziológiai folyamatokban fellépő nagyjából 24 órás ciklust, amely az egysejtűektől a gerincesekig megtalálható. Ez a biológiai ritmus az endogén belső óráink és a fény mint fő „Zeitgeber” szinkronizációjának eredménye. Az emlősökben a hypothalamus területén elhelyezkedő nucleus suprachiasmaticus (SCN) tekinthető a szervezet „főórájának”, ami felelős a különböző szervrendszerekben található perifériás órák összehangolásáért. A cirkadián ritmus szabályozása az úgynevezett „circadian locomotor output cycles kaput”, a CLOCK géneknek a feladata. A CLOCK gének más effektor génekre hatva, a fehérjeszintézis diurnalis ritmusát szabályozzák. A cirkadián ritmus celluláris mechanizmusainak feltárását 2017-ben Nobel-díjjal jutalmazták. Egyre több adat bizonyítja a CLOCK gének és a daganatok kialakulása közötti összefüggést. Több tanulmány kapcsolatot mutat a váltott műszakban történő munkavégzés és az emlő-, valamint prosztatarák kialakulása között, valamint egyes cirkadián ritmust szabályozó gének mutációja és a tumoros elváltozás kifejlődése között. Egyre több adat utal a tumormetabolizmus és a CLOCK gének, azok szabályozása közötti kapcsolatra is. Mindezen adatok alapján a cirkadián ritmus, így a napszakok figyelembevétele a daganatterápiás kezelés során indokolttá válhat.
Daganattúlélők nőihormon-pótló kezelése – Irodalmi áttekintés
Az onkológia gyors fejlődése az onkológiai betegek mind hosszabb túléléséhez vezet. Közülük egyre többen érik el a természetes menopauzát, vagy onkoterápiájuk mellékhatásaként idő előtt tapasztalják a gonadalis funkciók megszűnését, vazomotoros tünetekkel és hosszú távú negatív cardiovascularis és csontrendszerre gyakorolt hatásokkal. Egyre növekvő számban kérnek ilyen betegek endokrinológiai segítséget hormonpótló terápia (HRT) formájában. A WHI (Women’s Health Initiative) tanulmány eredményeinek téves értelmezése irracionális félelemhez vezetett a nőihormon-pótlás tekintetében mind a betegek, mind az orvosok körében. Számos orvos számára logikus és biztonságos következtetésnek tűnik a HRT elkerülése, feltételezve, hogy ez a hozzáállás biztosan nem okoz kárt, míg az ösztrogén önmagában vagy gesztagénekkel történő alkalmazása onkológiai és thrombemboliás kockázatokat hordoz, szövődmények esetén pedig peres eljárásokhoz is vezethet. Ugyanakkor már a WHI-tanulmány eredményei előtt is ismert volt, hogy a korai menopauza és hypogonadismus a skeletalis és a cardiovascularis hatások révén évekkel csökkenti a nők várható élettartamát, és ez a negatív hatás korrelál a hypoestrogenaemiás időszak hosszával. HRT-ről való döntés esetén ezeket a pró és kontra érveket kell mérlegelni úgy, hogy a HRT onkológiai kockázatát rendkívül nehéz objektíven felbecsülni. Összefoglaló tanulmányunkban áttekintjük a témával kapcsolatos legfrissebb evidenciákat az in vitro kísérletektől a klinikai vizsgálatokig, mind nőgyógyászati, mind nem nőgyógyászati daganatok túlélőinek vonatkozásában. Ez alapján a következő csoportokat határoztuk meg: a „HRT előnyös” (például I-es típusú endometriumcarcinoma, méhnyak-adenocarcinoma, malignus hematológiai betegségek, lokális melanoma malignum, colorectalis carcinoma, hepatocellularis carcinoma); a „HRT neutrális” (például BRCA 1/2 mutációt hordozóknál tumoros megbetegedés nélkül, II-es típusú endometriumcarcinoma, méhcarcinosarcoma és adenosarcoma, egyes ovariumtumorok, méhnyak-, hüvelyi és vulvalaphámrák, prolactinoma, veserák, hasnyálmirigyrák, pajzsmirigyrák); a „HRT relatíve ellenjavallt” különféle okok miatt (például leiomyosarcoma, bizonyos petefészekrákok, agydaganatok, előrehaladott metasztatikus malignus melanoma, tüdőrák, gyomorrák, húgyhólyagrák esetén); a „HRT kedvezőtlen hatású, ezért ellenjavallt” (például emlőrák, endometrium-, stromasarcoma, meningioma, glioma, hormonreceptor-pozitív gyomor- és hólyagrák).
A kemoterápia daganatkeltő hatása
Kemoterápia nélkül a felfedezett daganatos betegségek ötéves túlélési rátája – daganatfüggően – 0–15% között lenne, a jelenlegi terápia alkalmazásával 17-85%. Ugyanakkor számos figyelmeztetés hívja fel a figyelmet a kemoterápia által indukált nemkívánatos mellékhatások, legfőképpen a lehetséges tumorindukciós képesség veszélyeire, ami az öt éven túl gyógyult betegek 5-10%-át is érintheti. A szisztémás kemoterápiában használt egyes gyógyszerek (alkilálószerek, etopozid, arzén-trioxid) képesek a szervezet egészséges sejtjeiben mutációt okozni, amivel megnő a valószínűsége annak, hogy a mutációt szenvedett sejtek egy későbbi (szekunder) daganatképződést indítsanak el. A mutagén hatások mellett egyes kemoterapeutikumok a szervezet normális myeloid és epithelialis sejtjeire fejtenek ki olyan hatásokat, amelyek a szöveti mikrokörnyezet átalakításával megteremtik a malignus transzformáció lehetőségét. Ebben a folyamatban igen fontos szereplők a tumorokkal asszociáló makrofágok (TAM), amelyek a daganatsejt által szekretált faktorok és mikroszómák hatására megváltoztathatják génexpressziós mintázatukat, és prokarcinogén szignálokkal segítik a tumorsejtek megmaradását, invazivitását, csökkentik a citotoxikus T-sejtek aktivitását. Mindezen okok miatt kiemelten fontos az, hogy a daganatkeltő mutagénekkel dolgozó orvosok, gyógyszerészek, technikusok és nővérek ne kerüljenek közvetlen érintkezésbe ezekkel a veszélyes anyagokkal, hanem használjanak megfelelő védőfelszerelést.
Petefészekrákban szenvedő betegek nem sebészi kezelése
A petefészekrákban szenvedő betegek kezelésében alapvető a kellően radikális műtét, amely az egyéb módszerek eredményességét is meghatározza. Az ezt követően, egy ülésben végzett hyperthermiás intraperitonealis kemoterápia 40,5–42,5 Celsius-fokos citosztatikus oldat perfúziójával történik. A szisztémás kezelések megválasztásában a hat hónapos progressziómentesség a mérföldkő, ezentúl platinaszenzitív, ezen belül -refrakter vagy -rezisztens betegségről van szó. A citosztatikus kezelés fejlődése az alkilálószerektől a platinaszármazékokon át a paklitaxel alkalmazásáig terjed, különféle kombinációkkal, egyre jobb eredményekkel és mind kevesebb mellékhatással. A célzott terápiában az érújdonképződés-gátlók (főleg a bevacizumab) és a DNS-hibák javítását megakadályozó, PARP-gátlók a legjelentősebbek; ez utóbbiak esetében általában a platinaérzékenység feltétel, míg a BRCA-mutáció már nem mindig követelmény. Az utóbbi időben az immunterápiával kapcsolatban is ígéretes vizsgálatok folynak. A hormonkezelés fő előnye a jó tolerálhatóság. A gyógyszerek alkalmazásának sikerei mellett visszaszorulni látszik a sugárterápia, pedig a teljes peritonealis felszín ellátása – különösen a korszerű besugárzási technikák alkalmazása mellett – a kemoterápia alternatívája lehet, a palliatív irradiáció pedig a tünetek csökkentése mellett a gyógyszermentes időszakot is megnyújthatja, s a kombinálás lehetőségei további távlatokat nyitnak meg.
1.
2.
3.
4.
5.
1.
2.
3.
4.
Klinikum
Véletlen folytán, egy egyszerű vérvétellel derülhet ki az egyik legsúlyosabb gyerekbetegség5.