Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 117
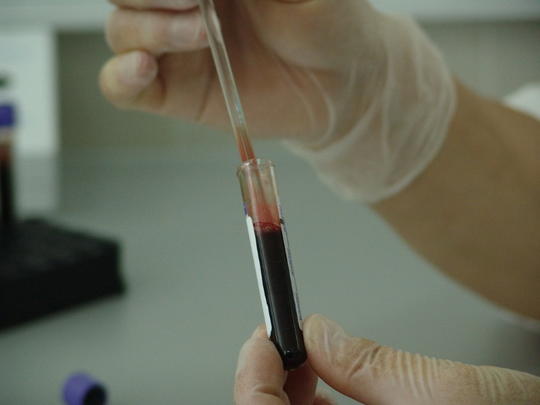
Mikor érdemes bevenni a vérnyomáscsökkentőt? Reggel és/vagy este?
A vérnyomás cirkadián (24 órás) variabilitását állandó és változó (külső és belső) tényezők befolyásolják. Ezeknek és 24 órás ambuláns vérnyomás- monitorozással (ABPM) meghatározott hypertonia-fenotípusnak az ismeretében lehet az individuális kronofarmakológiai szempontú kezelést (a magas vérnyomás kronofarmakoterápiáját) megtervezni. Jelentős különbségek vannak a különböző időpontokban adagolt antihipertenzív gyógyszerek kronokinetikájában. Terápiás tartományuk, hatékonyságuk jelentősen függ a cirkadián időpontbeli adagolásuktól. Bár a legtöbb korszerű antihipertenzívum 24 órás hatású, de mégsem képesek minden időpontban a vérnyomást azonos mértékben csökkenteni. Az ACE-gátlók, az ARB-k és az alfa-receptor-blokkolók reggeli bevétele elsősorban a délutáni, kora esti emelkedést befolyásolják, az esti bevétel az éjjeli, hajnali emelkedéseket csökkenti. A kalciumcsatorna-blokkolók, a béta-receptor-blokkolók (kivéve karvedilol és labetolol) nem hatnak a cirkadián vérnyomásprofilra. Ezért nondipper hypertoniában, illetve hajnali emelkedéseknél a kétszeri: reggeli és esti adás hatékonyabb a reggeli egyszeri adásnál (általában este kisebb dózis elegendő). Az éjszakai vagy hajnali vérnyomás-emelkedések megfelelő kontrollját az este bevett gyógyszerrel lehet elérni. Releváns tanulmányok szerint jelenleg nincsenek egyértelmű evidenciák arra vonatkozóan, hogy az esti bevétel révén megelőzhetők a szervkárosodások vagy csökkenthetők a cardiovascularis események, ezért nem ajánlható a kizárólagos esti bevétel. Ez különösen igaz idős pácienseknél, mert olyan mértékű lehet az éjszakai vérnyomásesés, amely növelheti a néma cerebralis infarctusnak a kockázatát és coronariabetegeknél a myocardiumischaemia rizikóját.
[Lehetséges genotípus-fenotípus korrelációk C típusú Niemann–Pick-kórban és a betegek miglustatkezelése]
[A C típusú Niemann–Pick-kór károsodott intracelluláris koleszterintranszport miatt kialakuló, ritka lizoszomális tárolási betegség. Az autoszomális recesszív betegséget az NPC1 vagy NPC2 gén mutációi okozzák. Értékeltük kora újszülöttkori, C típusú Niemann–Pick-kórral diagnosztizált betegeink klinikai és laboratóriumi tüneteit, a genotípusuk és a fenotípusuk közötti korrelációt és a miglustatkezelésre adott válaszukat. Tanulmányunkban bemutatjuk négy, C típusú Niemann–Pick-kórral kora újszülöttkorban diagnosztizált beteg esetét. Betegeink közös tünete volt a hepato- és splenomegalia, a cholestasis és a mozgásfejlődés visszamaradása. Az 1-es és a 2-es beteg (ikrek) az NPC1 gén c.2776G>A p.(Ala926Thr) homozigóta mutációjával és súlyos fokú tüdőérintettséggel bírt. A tüdőérintettség, ami a szakirodalom szerint általában az NPC2 gén mutációjával jár együtt, betegeinkben olyan súlyos fokú volt, ami korai halálukat eredményezte. A 3-as és 4-es beteg az NPC1 gén c.2972del p.(Gln991Argfs*6) mutációjával és az NPC2 gén homozigóta c.133C>T p.(Gln45*) mutációjával bír. Ennél a két betegnél miglustatkezelés hatására a neurológiai tünetek javulását figyeltük meg. Ikerpár betegeinknél súlyos fokú tüdőérintettséget figyeltünk meg. A négy közül kettő, kora újszülöttkori, C típusú Niemann–Pick-kórral diagnosztizált betegünk neurológiai tünetei a miglustatkezelés hatására javultak.]
Az új európai lipidcélértékek teljesülése a napi gyakorlatban
A nagyon nagy cardiovascularis kockázatú, 2-es típusú diabetesben szenvedő betegek lipidszintjeire vonatkozóan a European Society of Cardiology (ESC) és a European Atherosclerosis Society (EAS) 2019-ben közösen kiadott európai ajánlása új, az eddigieknél alacsonyabb célértékeket javasol: az LDL-koleszterin-koncentrációt 1,4 mmol/l (55 mg/dl) alá, a nem HDL-koleszterin értékét 2,2 mmol/l (85 mg/dl) alá kell szorítani. Egy nemrég megjelent, megfigyelésen alapuló tanulmány fontos adalékokkal szolgál arra, hogy milyen gyakran valósulnak meg az irányelv ajánlásai, továbbá hogy az elsődleges és másodlagos lipidcélok együttes elérése milyen fenotípusoktól és terápiás tényezőktől függ.
Nem tudunk arról, hogy a koronavírus fenotípusa megváltozott volna
Immár tíz hónapja van a világnak tudomása a SARS-CoV-2 új típusú koronavírusról. Noha a vírus minden bizonnyal Kínában alakult ki, vélhetően egy denevér-koronavírus emberre ugrásával ma már a világ minden országába eljutott. Ezekben a hetekben kellett aggasztóan gyorsan szembesülnünk a második hullám elkezdődésével. Interjúalanyunk, Jakab Ferenc, a Pécsi Tudományegyetem Szentágothai János Kutatóközpont Virológiai Kutatócsoportjának vezetője szeptember közepén sokkoló őszinteséggel beszélt arról, hogy Magyarország az egyik vezető európai ország lett a járvány terjedésének tekintetében, aminek következtében sajnos a halálesetek száma is rekordmagasságba emelkedhet a közeljövőben. Arról kérdeztük, mit tudtunk meg az elmúlt hónapok során a vírusról, és ez alapján mire számíthatunk az előttünk álló nehéz hónapokban.
A humán immunrendszer rendszerelvű megközelítése
A nukleotidpolimorfizmusok kutatása révén kiderült, hogy az autoimmun betegségek kialakulásában nagyon kis hatáserősséggel nagyon sok genetikai lokusz közreműködik, és itt is kiderült, hogy egy-egy kórkép molekuláris heterogenitása – pl. SLE esetén – milyen óriási. E betegségek kezelését forradalmasította a biologikumok rendszerimmunológiának köszönhető bevezetése.
A hypoxia jelentősége a rosszindulatú daganatok progressziójában: terápiás lehetőségek, út a Nobel-díjhoz
Az elmúlt évtizedek kutatásai világossá tették, hogy a malignus daganatok egyik meghatározó jellemzője hypoxiás állapotuk és az ennek következtében aktiválódó genetikai, biokémiai és biológiai programok. A felismerés jelentőségét mi sem bizonyítja jobban, mint hogy 2019-ben az orvosi Nobel- díjat ezért ítélték oda a terület meghatározó tudósainak. A daganatszövetben keletkező hypoxia fő oka a proliferációval lépést nem tartó ereződés, de másik fontos oka a daganatos beteg szisztémás hypoxiája is. A hypoxiára adandó sejtes válaszok alapja a hypoxia indukálta (transzkripciós) faktorok stabilizálódása és aktivizálódása, ami azonban daganatokban az onkogén jelpályák konstitutív aktivitása miatt is bekövetkezhet hypoxia nélkül is. A daganatos hypoxia következménye az angiogén fenotípus, a sejtmetabolizmus átprogramozódása és a daganatellenes immunológiai válaszreakciók kedvezőtlen modulációja. A daganatszövet hypoxiája azonban negatívan befolyásolja a kemo-, sugár- és immunterápia hatékonyságát is. Mindezek miatt nagy szükség lenne a daganatos hypoxia célzott terápiájára, aminek első eszközei még csak most lépnek be a klinikai gyakorlatba. Fontos megjegyezni, hogy hazai kutatócsoportok nemzetközileg is elismert eredményekkel járultak hozzá ismereteink bővüléséhez ezen a területen.
A fehérköpeny- és a maszkírozott hypertonia jelentősége
A fehérköpeny-hypertonia heterogén klinikai entitás, amelyben kisebb és nagyobb cardiovascularis kockázatú betegek egyaránt előfordulnak. Prognózisa szerint relatíve jóindulatú, amennyiben nem társul egyéb cardiovascularis kockázati tényezőkkel.
Az áttétes colorectalis rák molekuláris altípusai és a terápiás döntések fejlődése
A colorectalis ráknak (CRC) klinikailag igen jelentős molekuláris heterogenitása van, amely különböző szinteken jelentkezik: a genomikában, az epigenomikában, a transzkripcióban és a mikrokörnyezetben. A karcinogenezis során szerzett genomikus történések hajtják („drive”) áttétes helyzetben a rák progresszióját. Például a KRAS- és az NRAS-mutációk jelzik azokat a daganatsejt-populációkat, amelyek refrakterek az EGFR monoklonális antitestekre, a BRAFV600E-mutációt hordozók viszont rosszabb kimenetelre számíthatnak a standard kezelések és a kombinált célzott kezelések mellett, míg a HER2-amplifi káció arra utal, hogy a daganat különlegesen érzékeny egy kettős HER2-blokáddal szemben. A többszörös, ritka géneltérések által hajtott EGFR monoklonális antitestek elleni rezisztencia jelentős átfedésben van a primer, valamint a szerzett rezisztencia mechanizmusában a klónszelekciós folyamat során. Ebben a tekintetben refrakter esetekben a keringő tumor-DNS szekvenciális vizsgálata vezethet gyógyszerek kifejlesztéséhez. A ritka kinázfúziós események és a DNS-károsodás utáni repair-ben részt vevő gének komplex eltéréseit is leírták, amelyek a célzott kezelések targetjei lehetnek. Másrészt a transzkripció szubtípusai és a jelátviteli utak aktivációs jelei szintén prognosztikai és potenciálisan prediktív értékkel bírnak áttétes colorectalis rákban. Ezek a jelek a stromalis sejtek és az immunkörnyezeti sejtek, valamint a daganatsejtek közötti interakciókat jelzik. Például a mikroszatellita-instabilitást mutató (MSI) vagy a POLE ultramutáns CRC-daganatsejtek különlegesen érzékenyek az immunellenőrzőpont-gátlókra, míg az olyan mesenchymalis fenotípusú daganatok, amelyeket az immunszuppresszív molekulák aktivációja jellemez, jó tárgyai lehetnek egy új immunterápiás kombináció kialakítására. Ebben a cikkben átnézzük az áttétes CRC-ben kimutatott, célzott terápiára alkalmas onkogéneltéréseket és -szignatúrákat, valamint tárgyaljuk az új molekuláris diagnosztikus próbák klinikai alkalmazásának lehetőségeit.
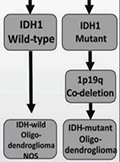
[Az izocitrát-dehidrogenáz-mutációk szerepe a glioblastoma biológiájában és a terápiás döntéshozatalban]
[Az onkogenezis sorozatos szomatikus mutációk felhalmozódásához köthető. Számos daganat esetében megtörtént a genomikai háttér átfogó elemzése, és a glioblastoma az elsők között volt.]
EMT (epithelialis-mesenchymalis átmenet) – CSC (daganatos őssejtek)
A daganatellenes kezelés hatékonysága rendszerint korlátozott a gyógyszerekkel szembeni rezisztencia miatt. A szerzett rezisztencia egyik fontos oka az intratumoralis heterogenitás, ami a daganatsejtek fenotípusa közötti változatosságot jelenti egy tumoron belül. Ez a heterogenitás a genotípust érinti elsősorban. A daganatos őssejtek (cancer stem cell, CSC) a koncepció szerint képesek meghatározni a daganat progresszióját, a klinikai onkológia legnagyobb kihívásaként metasztázisok létrejöttét. Hogy ez kialakuljon, a tapasztalatok szerint hámeredetű daganatoknál az epithelialis karaktert mesenchymalisnak kell felváltania (epithelial-mesenchymal transition), ha nem is teljesen. A CSC fenotípusához tartozik, a normális szöveti őssejtekhez hasonlóan. a szerekkel szembeni rezisztencia, illetve a károsításokat követő regeneráció. Ezeknek a tulajdonságoknak a szabályozó mechanizmusa még alig ismert, de minden bizonnyal ebben genetikai és epigenetikai tényezők egyaránt szerepet játszanak. Ha ezeket terápiás célpontként megismerjük, talán a leghatékonyabb kezelési stratégia birtokába juthatunk.
1.
2.
3.
4.
5.
1.
2.
3.
Egészségpolitika
A Magyar Járóbeteg Szakellátási Szövetség állásfoglalása az ágazat helyzetéről4.
Gondolat
Üdv nálunk! Van már, aki írja a fekete pontjaid? – Nyomasztás a közoktatásban5.