Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 523
Sugárterápia indukálta másodlagos daganatok
Az onkológiai kezelések szerves részét képezi a sugárterápia, amiben a betegek közel fele részesül. A modern onkológiai kezeléseknek köszönhetően a túlélés egyre hosszabb, így a betegek körülbelül egyötöde megéli azt is, hogy egy második tumor kialakuljon. Több tanulmány szerint maga az onkológiai kezelés is összefüggésbe hozható a másodlagos primer tumor kialakulásával, ami egyes becslések szerint az esetek 5-8%-ában lehet a sugárterápia következménye. Nagy kihívást jelent, hogy megértsük a sugárterápia okozta hatásokat az esetlegesen túlélő daganatsejtekben, a daganatot körülölelő egészséges szövetekben, az alacsony dózisban részesült területekben, illetve az egyáltalán nem irradiált szövetekben, ahol abszkopális hatások érvényesülhetnek. Ezek együttes hatása tehető felelőssé az úgynevezett radiokarcinogenezis kialakulásáért. Manapság számos tanulmány foglalkozik a sugárterápia daganatindukáló hatásaival. Ez az összefoglaló arra hivatott, hogy áttekintse a témával kapcsolatos ismereteinket a patogenezis, radiogenomikai, sugárfizikai és sugárbiológiai szempontok alapján, továbbá tárgyalja a megelőzés és a szűrés lehetőségeit. A sugárterápia kétélű fegyver, amely egyrészt nagyon jól alkalmazható a daganatos betegségek kuratív kezelésében, másrészt azonban potencionálisan másodlagos daganatot indukálhat, amely évekkel később jelentkezik. Emiatt a jövőben a maximálisan optimalizált, személyre szabott sugárterápiának lehet csak létjogosultsága.
A daganatos elváltozások hatékony diagnosztikáját segítő labort alakítottak ki Szegeden
A daganatos elváltozások hatékony diagnosztikáját segítő laboratóriumot alakítottak ki uniós támogatással a Szegedi Tudományegyetem (SZTE) patológiai intézetében – tájékoztatta a felsőoktatási intézmény közkapcsolati igazgatósága az MTI-t.
A méhnyakrák korszerű onkológiai kezelése
Világszerte évente több mint félmillió nőnél igazolódik méhnyakrák, és körülbelül 300 000 halálesetet okoz a betegség. A nyugati társadalmakban a cervixcarcinoma incidenciája és mortalitása csökken a humán papilloma vírus (HPV) elleni vakcinációnak és a populációs szintű szűrésnek köszönhetően. A fejlődő világ országaiban azonban továbbra is emelkedő a tendencia. A rákmegelőző állapotok és a korai méhnyakrák definitív onkológiai ellátása a stádiumfüggő kiterjesztéssel végzett műtétek révén lehetséges. A posztoperatív sugárkezelés vagy kemoradioterápia szükségessége a patológiai rizikófaktorok alapján határozható meg. Előrehaladott méhnyakrákban a definitív kemoradioterápia vagy a szisztémás kezelés a terápiás alternatívák. A fiatal betegek részéről gyakran felmerülő kívánság a fertilitásmegtartás, amely az onkológiai elvekkel csak jól definiált határok között egyeztethető össze, alapos felvilágosítást követően. A terhesség alatt felismert méhnyakrák becsült incidenciája 1,4-4,6 eset/100 000 szülés, amelynek ellátása során, az onkológiai szempontokon túl, a magzat biztonságát is szem előtt kell tartanunk az anya preferenciái alapján. A klasszikus kemoterápia mellett a biológiai szerek is megjelentek a közelmúltban a méhnyakrák szisztémás kezelési lehetőségei között: első vonalban bevacizumabbal egészíthető ki a ciszplatin-paclitaxel kombináció közel négy hónapos túlélési előnyt nyújtva a betegek számára; míg másodvonalban pembrolizumab adható mikroszatellita-instabil vagy PDL-1-et expresszáló (combined positive score [CPS] ≥1), illetve magas tumormutációs terheltséget (TMB ≥10) mutató daganatok esetén. A jelen munka egy rövid összefoglalót szolgáltat a méhnyakrák megelőzéséről, kivizsgálásáról és onkológiai ellátásáról.
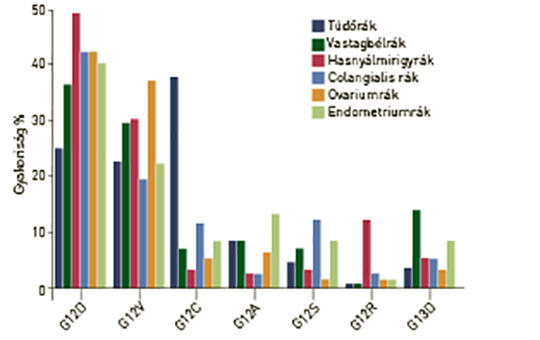
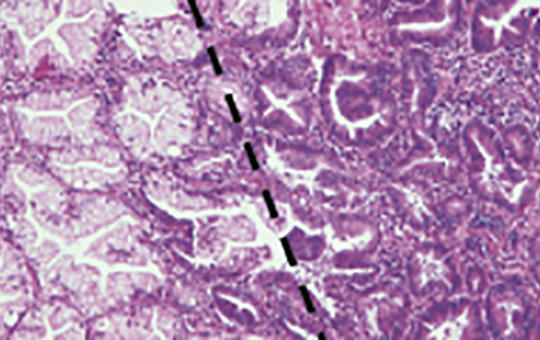
A (K)RAS-mutáció molekuláris epidemiológiája emberi daganatokban
A RAS onkogén mutációja a leggyakoribb génhiba emberi daganatokban, és a három családtag közül a K-RAS-é a leggyakoribb, amit az N-RAS követ. A tipikus K-RAS-mutáns daganatok a hasnyálmirigyrák, vastagbélrák és tüdő-adenocarcinoma, amelyekben a mutáns variáns allélok gyakorisága igen heterogén, aminek hátterében eltérő karcinogenezis áll. A RAS-mutáns daganatok genetikai sokszínűségét tovább fokozza, hogy a mutáns allél homo- vagy heterozigóta formában van-e jelen. A sokszínűség egy másik forrása az, hogy a különféle daganatokban a K-RAS-mutánsok esetében sajátos kísérő mutációs mintázatú altípusok lehetnek. Mindezeknek az a következménye, hogy a K-RAS-mutáns daganatok biológiai viselkedése és nagy valószínűséggel terápiás érzékenysége is nagyon heterogén lehet. A K-RAS-inhibitorok klinikai debütálásával ezeknek a kérdéseknek egyre nagyobb jelentősége lesz.
A magasvérnyomás-betegség előfordulása és kezelése frissen diagnosztizált familiáris hypercholesterinaemiás betegekben
A familiáris hypercholesterinaemia (FH) a koleszterinanyagcsere veleszületett zavarával járó kórkép, amelyet jelentősen emelkedett összkoleszterinszint (TC) és low density lipoprotein koleszterinszint (LDL-C), ennek következtében a szív- és érrendszeri betegségek korai megjelenése jellemez. A magas vérnyomás előfordulási gyakorisága FH-s betegekben nem tisztázott, de jelenléte független kockázati tényezője a cardiovascularis betegség kialakulásának. Megfelelő terápiája ezért kiemelt fontosságú ebben a nagy kockázatú betegcsoportban. Célul tűztük ki 86, szakrendelésünkön először megjelent, frissen diagnosztizált, lipidcsökkentő kezelésben még nem részesülő heterozigóta FH-s beteg (27 férfi, 59 nő, átlagéletkoruk 53,6±13,4 év) esetén a lipidszintek, valamint a dokumentáció alapján a magas vérnyomás előfordulásának és kezelésének értékelését. Az FH diagnózisát a Dutch Lipid Network kritériumrendszer alkalmazásával állítottuk fel. A betegek átlagos TC-szintje 8,49±1,7 mmol/l, átlagos LDL-C-szintje 6,11±1,5 mmol/l, átlagos high density lipoprotein koleszterin (HDL-C) szintje 1,62±0,5 mmol/l, míg a lipoprotein-(a)-szint mediánja 301 mg/l volt. Mindössze 33 beteg esetén diagnosztizáltak korábban magas vérnyomást (38,4%). Béta-blokkolót 23, ACE-gátlót 13, ARB-t 12, kalciumcsatorna-blokkolót 9, HCT-t 11 beteg kapott. 11 beteg részesült monoterápiában, 10 beteg kettős, 11 beteg hármas, míg 1 beteg négyes kombinált kezelést kapott. Az eredmények alapján a magasvérnyomás-betegség ebben a betegcsoportban valószínűleg aluldiagnosztizált, a javasolt kezelés pedig sem az alkalmazott szer típusát, sem annak módját tekintve nem felelt meg az aktuális terápiás irányelveknek. A magasvérnyomás-betegség szűrése és korszerű kezelése, tekintettel az FH esetén kialakuló korai érelmeszesedésre, jóval nagyobb figyelmet érdemel ebben a kiemelt kockázatú betegcsoportban.
Hírvilág
2021. FEBRUÁR 03.
Rákellenes világnap
A Rákellenes Világnapot immár 21 éve tartják minden év február 4-én. Idén van a Nemzetközi Rákellenes Unió (UICC) hároméves „Ez vagyok és ezt teszem” (I am and I will) kampány utolsó éve. A Magyar Rákellenes Liga mindenkit hív, hogy sétáljon, fusson, mozogjon velük 30 percet a Rákellenes Világnapon.
Heterogenitás és a daganatok
A sejtek alapvető feladata, hogy fenntartsák az egyensúlyt a proliferáció és a programozott sejthalál között, amely lehetőséget ad a sejt számára, hogy specifikus feladatát végrehajtsa. Ez a folyamat szorosan összekapcsolódik a szomszédos sejtekkel, továbbá a sejtek közötti állománnyal is. Mindezek szabályozásában hibák keletkezhetnek, persze leggyakrabban mutációk. Ezek némelyike a sejt életében zavarokat okozhat, azonban a mutációk többsége nem játszik fontos szerepet. Jól ismert a benignitás és a malignitás elkülönítése, amelyből a daganatsejtek metasztatizálása az igazi veszély. (Tulajdonképpen klinikailag akkor lehet malignusnak tekinteni egy daganatot, ha képes a metasztatizálásra.) Ez az említett hiba lehet veleszületett és szerzett, amellyel a normális klonális jelenlétet fokozatosan uniklonálissá változtatja (inkább a hematológiai tumorokban, mintsem a szolidokban), és ez a poliklonalitás összezavarja a sejt funkcionális képességét. Érthető tehát, hogy ezt a két jelenséget, a metasztatizálást és a szelekciót tekinthetjük a terápia első számú célpontjának. A heterogenitás fontos szerepet játszik a sejtek életében.
A CT-vizsgálatok mellékhatásai
A képalkotó radiológiai diagnosztikai eljárások körében egyre terjednek a viszonylag nagy dózisú sugárexpozíciót eredményező, de vitathatatlan diagnosztikus előnyt mutató komputertomográfiás (CT-) vizsgálatok. A sztochasztikus sugárhatások lineáris, küszöbdózis nélküli modellje alapján a legkisebb elszenvedett sugárdózis is kiválthatja daganatok keletkezését. A CT-vizsgálatok során elszenvedett sugárexpozíció miatt kialakuló daganatkeletkezés, magasabb sugárérzékenységük és várható hosszabb élettartamuk miatt, elsősorban a fiatal korosztályt érinti. A témakört vizsgáló legtöbb epidemiológiai tanulmány arra a következtetésre jutott, hogy a CT-vizsgálatok dózisfüggően megnövelik fiatalokban a leukémiák és agydaganatok kialakulásának a kockázatát. Az abszolút daganatszámok azonban nem jelentősek, így megfelelő indikáció esetén a vizsgálatot a lehető leghamarabb el kell végezni. Állapotos nőkön végzett, az alhasi régiót érintő CT-vizsgálatok fejlődési rendellenességek kialakulásához vezethetnek a magzatban. Az esetek túlnyomó többségében azonban csak sorozat-CT-vizsgálatok eredményezhetnek 100 mGy feletti magzati expozíciót, amely felvetheti a terhesség megszakítását. A sugárexpozícióval járó képalkotó vizsgálatok indokoltságáért, optimált elvégzéséért a kezelőorvos a felelős.
Agnosztikus terápia onkológiai alkalmazása
A tumoragnosztikus terápia az onkológiai kezelés ígéretes lehetősége, azonban a potenciális célpontok klasszifikálása, validálása, azok egységes módszerek szerinti kimutatása elengedhetetlen. A tumoragnosztikus kezelések engedélyezése új típusú, biomarker-vezérelt klinikai vizsgálatok bevezetését tette szükségessé. Jelenleg három tumoragnosztikus molekuláris célpont ismert: a daganatok magas fokú mikroszatellita-instabilitása (MSI-H), a neurotrop-tirozinkináz-receptor (NTKR) gének fúziója, valamint a daganatok magas tumormutációs terhelése (TMB-H). A pembrolizumab (anti-PD-1 antitest) az első tumoragnosztikus indikációban is törzskönyvezett gyógyszer, amelyet először MSI-H daganatok kezelésére engedélyeztek, majd később a magas TMB is bekerült az indikációk közé. Az NTKR-fúziót hordozó daganatok kezelésére a larotrectinib és az entrectinib került engedélyezésre.
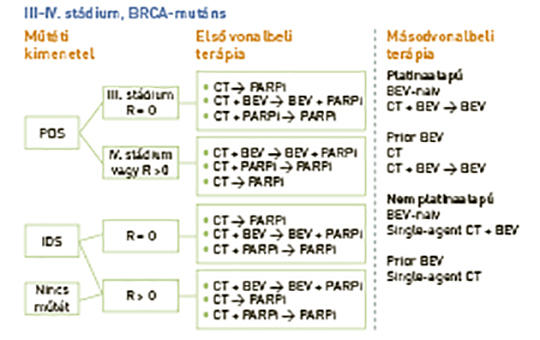
A petefészekrák kezelésének frontvonalában: a PARP-gátlók szerepének megújítása
Kiújult petefészekrákban a poli(ADP-ribóz)polimeráz- (PARP-) gátlókkal történő kezelések megváltoztatták a platinaérzékeny daganatok kezelését. Az új adatok szerint a PARP-gátlókat a kezelési algoritmus korábbi szakaszában kell alkalmazni. A kutatók számba veszik azokat a fázis III vizsgálatokat, amelyekben a PARP-gátlók hatását értékelték újonnan diagnosztizált petefészekrákok primer, illetve fenntartó kezelésében. Megvitatják a gyógyszerek hatásosságát és biztonságosságát az összes daganat, illetve a biomarkerek szerint válogatott daganatok klinikai vizsgálataiban, és összevetik a különböző vizsgálatok előnyeit és korlátait. Fontolóra veszik a jövő kutatásainak prioritásait – különös tekintettel a betegek kiválasztására és a jövőben alkalmazandó, egyelőre hiányzó gyógyszeres regimenek megalkotására. Négy fázis III vizsgálatban (SOLO-1, PAOLA-1/ENGOT-OV25, PRIMA/ENGOT-OV26 és VELIA/GOG-3005) PARP-gátlók használatával (olaparib, niraparib vagy veliparib) a progressziómentes túlélés jelentős javulását figyelték meg petefészekrákos betegekben. A vizsgálatok eltérő kialakítása (kezelés vagy fenntartó kezelés, egy gyógyszeres vagy kombinációs kezelés, bevacizumabbal vagy bevacizumab nélkül), a betegek kiválasztása (műtéti eredmény, biomarkerek elérhetősége, prognózis szerint), a résztvevők eredeti megválasztása (intention-to-treat, BRCA-mutációs vagy homológ rekombinációdeficites pozitív) befolyásolták a vizsgálatokból levonható következtetéseket. A teljes túlélési adatok még függőben vannak, hosszú távú biztonságossági adatok is csak korlátozottan állnak rendelkezésre. A PARP-gátlók sarkalatos szerepet játszanak az újonnan kimutatott petefészekrák-ellátásban, és befolyásolják a további kezeléseket. Ki kell választani azokat a betegeket és gyógyszereket, akiknél az eddigi alkalmazott kezelések a PARP-gátlóknál kevesebb haszonnal járnának.
1.
2.
3.
4.
5.
1.
2.
3.
4.
Egészségpolitika
A Magyar Járóbeteg Szakellátási Szövetség állásfoglalása az ágazat helyzetéről5.
Gondolat
Üdv nálunk! Van már, aki írja a fekete pontjaid? – Nyomasztás a közoktatásban