Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 885
[A török kávé illatának hatása a Covid-19-betegek szaglászavaraira: Kísérleti klinikai tanulmány]
[A tanulmány célja a török kávé szippantásának Covid-19-betegek szaglására gyakorolt hatásának vizsgálata volt. A vizsgálat kísérlet-kontroll módszert alkalmazott. Az adatokat egy beteg- és betegséginformációs űrlap, valamint a Connecticut Kemoszenzoros Klinikai Kutatóközpont (CCCRC) Teszt segítségével gyűjtöttük össze. A vizsgálati Covid-19-betegcsoport török kávé illatát szagolta, és megvizsgáltuk ennek hatását a betegek szaglására. Az adatokat az SPSS 25. verziójával (IBM) elemeztük. A vizsgálati csoportba tartozó betegek 25%-ának mérsékelt, 58,3%-ának súlyos hyposmiája volt, és 16,7%-ára anosmia volt jellemző a török kávé szippantása előtt. A török kávét szippantó betegek 13,3%-a visszanyerte normális szaglási képességét, míg 18,3%-uk enyhe, 45%-uk mérsékelt, 6,7%-uk súlyos hyposmiától szenvedett, 16,7%-uk anosmiás maradt. A kontrollcsoportban nem volt különbség az első és a második mérés között a CCCRC Teszt értékeiben. Az 1 óra időtartamig török kávét szagoló Covid-19-betegek visszanyerték a szaglásuk egy részét. A török kávé olcsó, illatos, széles körben elérhető és könnyen hozzáférhető. Ennek a tanulmánynak az eredményei azt sugallják, hogy a török kávé szippantása ajánlható a Covid-19-betegek szaglási rendellenességeinek kezelésére.]
Az SZTE új 3D Központja az egyénre szabott gyógyítást segíti
A betegekre szabott egyéni gyógyítást, élettudományi kutatásokat, hozzájuk kapcsolódó oktatást, orvosképzést és innovációt támogat a Szegedi Tudományegyetem most lezárult 3D Központjának projektje. A háromdimenziós térbeli nyomtatás nemcsak műtétek pontos megtervezésére és implantátumok kinyomtatására ad lehetőséget: egyedi szerveket és biológiai szöveteket, a fül apró szerveit, protézist, koponya vagy állcsont pótlást, illetve ízületi porcfelszínt is tudnak vele „építeni” az orvosok és a kutatók.
A méhnyakrák korszerű onkológiai kezelése
Világszerte évente több mint félmillió nőnél igazolódik méhnyakrák, és körülbelül 300 000 halálesetet okoz a betegség. A nyugati társadalmakban a cervixcarcinoma incidenciája és mortalitása csökken a humán papilloma vírus (HPV) elleni vakcinációnak és a populációs szintű szűrésnek köszönhetően. A fejlődő világ országaiban azonban továbbra is emelkedő a tendencia. A rákmegelőző állapotok és a korai méhnyakrák definitív onkológiai ellátása a stádiumfüggő kiterjesztéssel végzett műtétek révén lehetséges. A posztoperatív sugárkezelés vagy kemoradioterápia szükségessége a patológiai rizikófaktorok alapján határozható meg. Előrehaladott méhnyakrákban a definitív kemoradioterápia vagy a szisztémás kezelés a terápiás alternatívák. A fiatal betegek részéről gyakran felmerülő kívánság a fertilitásmegtartás, amely az onkológiai elvekkel csak jól definiált határok között egyeztethető össze, alapos felvilágosítást követően. A terhesség alatt felismert méhnyakrák becsült incidenciája 1,4-4,6 eset/100 000 szülés, amelynek ellátása során, az onkológiai szempontokon túl, a magzat biztonságát is szem előtt kell tartanunk az anya preferenciái alapján. A klasszikus kemoterápia mellett a biológiai szerek is megjelentek a közelmúltban a méhnyakrák szisztémás kezelési lehetőségei között: első vonalban bevacizumabbal egészíthető ki a ciszplatin-paclitaxel kombináció közel négy hónapos túlélési előnyt nyújtva a betegek számára; míg másodvonalban pembrolizumab adható mikroszatellita-instabil vagy PDL-1-et expresszáló (combined positive score [CPS] ≥1), illetve magas tumormutációs terheltséget (TMB ≥10) mutató daganatok esetén. A jelen munka egy rövid összefoglalót szolgáltat a méhnyakrák megelőzéséről, kivizsgálásáról és onkológiai ellátásáról.
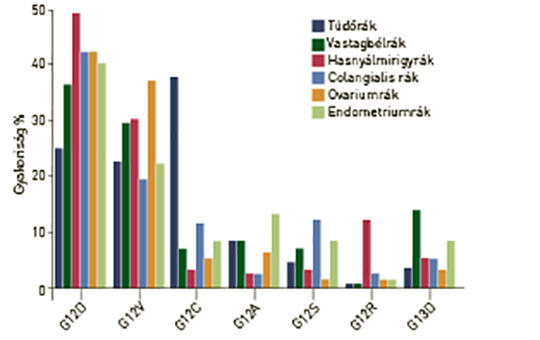
A (K)RAS-mutáció molekuláris epidemiológiája emberi daganatokban
A RAS onkogén mutációja a leggyakoribb génhiba emberi daganatokban, és a három családtag közül a K-RAS-é a leggyakoribb, amit az N-RAS követ. A tipikus K-RAS-mutáns daganatok a hasnyálmirigyrák, vastagbélrák és tüdő-adenocarcinoma, amelyekben a mutáns variáns allélok gyakorisága igen heterogén, aminek hátterében eltérő karcinogenezis áll. A RAS-mutáns daganatok genetikai sokszínűségét tovább fokozza, hogy a mutáns allél homo- vagy heterozigóta formában van-e jelen. A sokszínűség egy másik forrása az, hogy a különféle daganatokban a K-RAS-mutánsok esetében sajátos kísérő mutációs mintázatú altípusok lehetnek. Mindezeknek az a következménye, hogy a K-RAS-mutáns daganatok biológiai viselkedése és nagy valószínűséggel terápiás érzékenysége is nagyon heterogén lehet. A K-RAS-inhibitorok klinikai debütálásával ezeknek a kérdéseknek egyre nagyobb jelentősége lesz.
Gondolat
2021. FEBRUÁR 10.
A neurózis nagyvárosi megjelenése és korai tapasztalatai – Orvosi és irodalmi diskurzusok 1900 körül
Tanulmányomban arra vállalkozom, hogy olyan forrásokat ismertetek és kommentálok, amelyek valamilyen módon érzékenyen reflektáltak a nagyvárosi idegességre mint újonnan megjelent és elterjedt betegségre. Az alábbiakban olyan orvosi regiszterű szövegeket mutatok be, melyek jelentős mértékben járultak hozzá a betegség képének kialakulásához és egyáltalán ahhoz a folyamathoz, hogy ezt a jelenséget betegségként kezdték számon tartani.
Hírvilág
2021. JANUÁR 28.
Folytatódik a főváros CT, MR programja
Nyílt közbeszerzési eljárást indított a Fővárosi Önkormányzat képalkotó diagnosztikai vizsgálatok elvégzésére
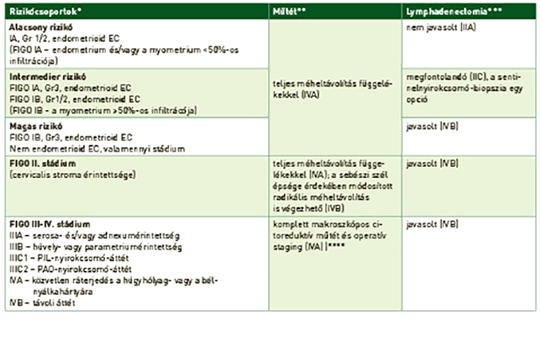
A méh rosszindulatú daganatainak korszerű onkológiai kezelése
Világviszonylatban évente közel 400 000 nőnél igazolódik méhtestrák, amely 2018-ban körülbelül 90 000 nő halálát okozta. Az esetek túlnyomó részét a méhnyálkahártya hormonérzékeny hámjából kiinduló endometriumcarcinomák (EC) alkotják. A sarcomák a méhtestrákok alig 3%-át adják. Az EC-k 80-85%-a jó prognózisú, mivel alacsony gradusú és korai stádiumban kerül felismerésre, amikor a műtét és az esetleges posztoperatív kezelés révén a gyógyulás reális terápiás cél. Az előrehaladott stádiumban diagnosztizált EC és a nem endometrioid altípusok esetén a prognózis lényegesen rosszabb. A magas rizikójú EC optimális adjuváns kezelésére irányuló vizsgálatok egy része még folyamatban van, illetve a bővülő molekuláris ismeretek újabb vizsgálatokat generálnak. A méhtestsarcomák esetében is a sebészi eltávolítás jelenthet kuratív megoldást, az adjuváns kezelésre vonatkozó evidenciák bizonytalanok, egyéni mérlegelést igényelnek. A modern onkoterápia érájában már nemcsak a betegségmentes élet meghosszabbítására, hanem az élet minőségének minél teljesebb megőrzésére is törekszünk. A nőgyógyászati onkológiában ezt jelenti a fertilitás vagy a funkcionáló ováriumok lehetőség szerinti megőrzése; a magas morbiditással járó szisztémás lymphadenectomia indikációs körének szűkítése; a kedvezőbb mellékhatásprofilú brachytherapia alkalmazása a teljes kismedencei besugárzás helyett. A modern onkoterápia az úgynevezett biológiai kezelések által az előrehaladott betegségek ellátásának is a részévé vált: kemoterápia mellett/után progrediáló esetekben a pembrolizumab az EC és a sarcomák esetén is alkalmazható mikroszatellita-instabilitás vagy magas tumormutációs terheltség esetén, míg az NTRK fúziós gén jelenlétében larotrectinib vagy entrectinib mint célzott tirozinkináz-gátlók javasolhatók. Az EC-k 70-80%-át kitevő mikroszatellita-stabil esetekben (nem endometrioid altípusokban is!) a pembrolizumab lenvatinibbel kombinációban adható a kemoterápia után. Az EC területén gyarapodnak továbbá az egyéb célzott terápiás szerekkel szerzett tapasztalatok is (anti-HER2 serosus carcinomában, mTOR-gátló kezelés, endokrin terápia, más immun checkpoint inhibitorok, tirozinkináz-gátlók, PARP-gátlók és kombinációs kezelések). A jelen munka a méhtestrákok onkoterápiájáról kíván rövid összefoglalást nyújtani az aktuális szakmai ajánlások és a folyamatban lévő vizsgálatok bemutatásával.
Az immunválasz néhány újonnan felismert hatásmechanizmusa és az immunológia szemléleti átalakulása
Az immunológia az egészséges és kóros immunválaszt tanulmányozó komplex tudomány. Ez az élettani, patofiziológiai tudományág az egyes mechanizmusok megértését elsősorban sejt- és molekuláris biológiai, genetikai, epigenetikai és (neuro)endokrinológiai megközelítéssel, illetve a patológiás folyamatok részleteinek feltárásával végzi. Az immunológia egyike a nagyon gyorsan fejlődő tudományoknak, eredményei visszahatnak más diszciplínákra is elméleti (például hálózattudományok, rendszer-biológia) és módszertani (monoklonális ellenanyagok, biomarkerek, immunoassay-ek) szinten egyaránt. Az immunológusok az elmúlt évtizedekben számos szemléleti változást értek meg, és sok, a hatásmechanizmusokban megnyilvánuló lényegi részletkérdés érvényesülését ismerték fel.
Okos eszközök – szerepük van a diagnosztikában
Valamennyi hitelesített mobil eszköznek fontos helye van a korai diagnosztikában. A legújabb kardiológiai irányelvek szerint elfogadott és már nélkülözhetetlen részei a korai, de akár előrehaladott betegségek felismerésnek. A szívritmuszavar felismerésének, kontrolljának egyik legfontosabb szereplőjévé váltak. Ma 300 ezer érintett, de a becslések szerint 30 év múlva számuk megháromszorozódik.
A citokinek fájdalomkeltő szerepe a központi idegrendszerben – az anticitokin-terápia közvetlen analgetikus hatása
A krónikus fájdalom érzékelésében, továbbításában, feldolgozásában és az agyi fájdalomkép megformálásában nociceptiv, neuropathiás és centrális mechanizmusok vesznek részt. A kórokozó jelenlétét vagy a szövetkárosodást jelző és a védekezést riadóztató molekulák, az alarminok kóros folyamatok sorát indítják el, amelyek gyulladásos fájdalomingert váltanak ki. A gyulladáskeltő citokineknek a fájdalom idegrendszeri szinten való megjelenítésében van döntő szerepe. A folyamatos gyulladásos ingerek az idegsejtek perifériás és központi érzékenyítésével aktiválják a fájdalomérzéssel kapcsolatos agyi területeket és kialakítják az összetett fájdalomképet, a fájdalommátrixot. Az agyi funkcionális kapcsolatok hálózatokban működnek és funkcionális MRI-vel képezhetők le. A citokinek a neuronokat közvetlenül, vagy más neuromediátorok révén közvetve aktiválják. A citokinreceptorok megjelennek a nociceptorokon és a magasabb rendű neuronokon is, valamint a különféle nem neuralis sejteken, mint a microglia vagy az astrocyták. Az idegrendszerben szinte mindenütt fellelhető citokinek a tumornekrózis-faktor és az interleukin 6. Jeladási útvonalaik a nukleáris faktor κB és a Janus-kináz enzimrendszere. Ezért a gyulladáskeltő citokinek és a Janus-kináz elsőrendű terápiás célpontok. Az anticitokin biologikumok és a kismolekulájú kinázgátlók rheumatoid arthritisben csökkentik a fájdalmat és javítják a működőképességet. A fájdalomcsökkenés nagyobb, mint ami csak a gyulladás klinikai biomarkereinek csökkenésétől várható lenne. A célzott biológiai és kémiai-biológiai válaszmódosítók korai és gyors fájdalomcsökkentő hatását az agyban kifejtett közvetlen analgetikus hatásnak tulajdonítják.
1.
2.
3.
4.
5.
1.
2.
3.
4.
5.
Ideggyógyászati Szemle Proceedings
A Magyar Stroke Társaság XVIII. Kongresszusa és a Magyar Neuroszonológiai Társaság XV. Konferenciája. Absztraktfüzet