Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Magyar Immunológia - 2006;5(02)
Tartalom
Tisztelt Kolléganõk és Kollégák, kedves Olvasóink!
A hűvös, esős május után végre valóban beköszöntött a nyár: akkora a kánikula, hogy a képernyőn még az ehhez szokott szaúdiak is szenvednek a zöld gyepen. Mit lehet ilyenkor tenni? Beülni egy kád hűvös vízbe - alternatívák: a Balatonba, tengerbe, kinek mi dukál -, kortyolgatni egy gyöngyöző üveg sört - pezsgőt, vizet, koktélt stb. - és élesíteni agyunkat a Magyar Immunológia olvasása közben.
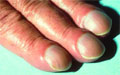
Mozgásszervi paraneoplasiás szindrómák
A mozgásszervi paraneoplasiák az arthropathiák, a myopathiák, az osteopathiák legkülönbözőbb formáiban jelentkezhetnek, de gyakran látjuk szisztémás autoimmun megbetegedések atípusos formáját is.
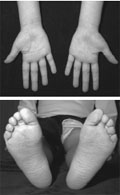
Familiáris autoinflammatoricus szindrómák
A látszólag ok nélküli, nagyfokú gyulladással zajló, ritka örökletes betegségcsoport, az úgynevezett familiáris autoinflammatoricus szindrómák gyermekkortól induló ritka, de egész életen át tartó tünetegyüttesek.
Az idegi eredetű növekedési faktor szerepe az immun- és a gyulladásos kórfolyamatokban, az autoimmun pajzsmirigybetegségekben
Az idegi eredetű növekedési faktor (nerve growth factor, NGF) neurotrop citokin; jelentős szerepet játszik - a központi és perifériás idegrendszeri hatások mellett - a gyulladásos és az immunfolyamatokban. A két típusú, magas (TrkA) és alacsony (p75) affinitású receptorok aktivációja a szignáltranszdukciós folyamatok során az apoptózis gátlását vagy indukcióját eredményezheti.
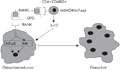
A RANK-RANKL-oszteoprotegerin rendszer molekuláris háttere és klinikai jelentősége
A „receptor activator of nuclear factor κB ligand” (RANKL) igen fontos citokin az osteoclastok fejlődésében és aktivációjában. Receptora, a RANK, az osteoclastok felszínén expresszálódik, és kapcsolatot létesít az osteoblastok és stromasejtek által termelt RANKL-lal.
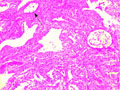
A pulmonalis artériás hipertenzió kórlefolyása, klinikai és immunszerológiai jellemzői kevert kötőszöveti betegségben
Kevert kötőszöveti betegséghez (mixed connective tissue disease, MCTD) társuló pulmonalis artériás hipertenzióban szenvedő betegek kórlefolyását, a túlélés valószínűségét, és az immunszerológiai eltéréseket vizsgáltuk. Az eredményeket összevetettük a pulmonalis artériás hipertenzió nélküli MCTD-s betegek értékeivel.
1.
2.
3.
4.
5.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
A Magyar Stroke Társaság XVIII. Kongresszusa és a Magyar Neuroszonológiai Társaság XV. Konferenciája. Absztraktfüzet5.