Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 416
A pajzsmirigyrákok molekuláris diagnosztikája és kezelése
A pajzsmirigydaganatok a leggyakoribb rosszindulatú endokrinológiai kórképek. A betegségcsoport diagnosztikai és kezelési szemlélete az utóbbi években jelentős átalakuláson ment keresztül. Az eddig alkalmazott klasszikus diagnosztikai algoritmusok kiegészültek az egyre szélesebb spektrumú és egyre könnyebben elérhető molekuláris diagnosztikai lehetőségekkel, amelyeknek köszönhetően a választott kezelés specifikusabb gyógymódot jelenthet a betegek számára. Ennek eredményeképp a visszatérő, kiterjedt kórállapotokban a molekuláris célpontú terápiák mára elkezdték kiszorítani a szisztémás kemoterápiákat a kezelési irányelvekből és sok esetben előléptek másodvonalbeli kezeléssé. Egyértelmű tehát a téma klinikai jelentősége és aktualitása, így jelen közleményünkben igyekszünk átfogó képet nyújtani a pajzsmirigyrák egyes szövettani altípusainak legkorszerűbb molekuláris diagnosztikájáról és kezelési stratégiáiról.
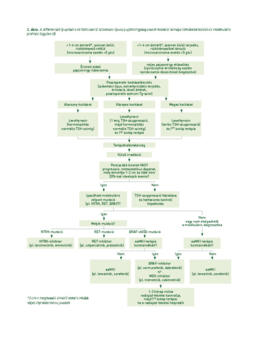
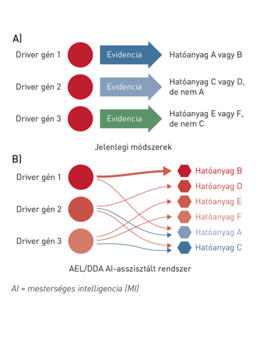
Mesterséges intelligenciával támogatott digitális terápiatervezés a precíziós onkológiában
A precíziós onkológiai megközelítés mára a rutinellátás részévé vált. Egyre több daganatos betegnél készül több száz génes molekuláris diagnosztikai vizsgálat, és több mint 100 célzott vagy immunterápiás gyógyszer van forgalomban. A megnyíló lehetőségek mellett ez kihívást is jelent, hiszen sok esetben több célzott terápiás kezelési lehetőség is rendelkezésre áll ugyanahhoz a biomarkerhez kapcsolódóan, a daganatban párhuzamosan jelen lévő – átlagosan négy-öt – genetikai eltérések módosíthatják a célzott terápiák hatásosságát, sőt egyre több esetben több célozható alteráció is kimutatható egy daganatban. Ilyen esetekben az optimális terápiás terv kialakítása jelenleg a molekuláris tumor boardok (MTB) felelőssége. Azonban több tanulmány kimutatta, hogy komplex molekuláris profilok esetén az MTB-k terápiás javaslata nagyon alacsony konkordanciát mutat. Automatizált döntéshozási módszerekre van szükség, hogy a döntéshozatal hatékonysága mérhetővé váljon, így a metódusok egymással összehasonlíthatók legyenek, és a betegek validált módon a leghatékonyabb döntési módszer alapján juthassanak kezeléshez. A digital drug assignment (DDA) algoritmus lehetőséget nyújt a terápiás döntések standardizálására, ha több célzott vagy immunterápiás kezelési lehetőség áll rendelkezésre, és más iránymutatás nem tesz különbséget a kezelésektől várható klinikai előny tekintetében. A módszer klinikai hasznosságának és biztonságosságának vizsgálata a SHIVA01 klinikai vizsgálat adatain történt.
Harmadvonalban alkalmazott terápiával elért hosszú, progressziómentes túlélés metasztatikus gyomorrákban
Hatvannyolc éves, nem dohányzó, jó általános állapotú, de kissé soványabb (BMI: 17) diabeteses, hypertoniás férfi beteg hasi fájdalom, melaena miatt került felvételre a területileg illetékes sürgősségi osztályra. Vérzésforrás lokalizációjának meghatározása céljából akut gasztroszkópiát végeztek nála, melynek során a gyomor kisgörbülete mentén nagy kiterjedésű, makroszkóposan malignusnak imponáló vérző fekélyt találtak. Sikeres endoszkópos vérzéscsillapítás (klipp + noradrenalinos injekció) történt, a laesióból vett minta szövettani vizsgálata magas grádusú intestinalis típusú adenocarcinomát igazolt.
Szakértői kommentár
Az ismertetett eset világosan rámutat a gyomorrák ellátásában is egyre meghatározottabbá váló interdiszciplináris együttműködés fontosságára. A terápiás beavatkozások tárházának bővülésével egyre több szakembert szükséges bevonni a palliatív kezelés teljes körű kivitelezésébe. Ez az együttműködés adja az inkurábilis betegeink számára is a lehető leghosszabb túlélési esélyt megtartott életminőségben. Ehhez alapvető feltétel minden egyes beteg ellátása esetén az onkoteam bevonása. Az esetben, a kezelhetőség feltételeinek megteremtésében, invazív endoszkópos szakember beavatkozására volt szükség. A megfelelő terápiás terv felállításához a patológus és napjainkban a molekuláris biológus lelete elengedhetetlen.
Az emberi agy feltáratlan GnRH-neuronrendszere
A szaporodás agyi szabályozásáért felelős gonadotropin-releasing hormont (GnRH) a legtöbb emlős fajban mindössze ~2000 idegsejt termeli és választja el neuroszekréció útján az agyalapi mirigy portalis keringési rendszerébe. Míg laboratóriumi rágcsálókban GnRH-idegsejtek kizárólag a preoptikus agyterületen helyezkednek el, post mortem emberi agyon végzett immunhisztokémiai megfigyeléseink GnRH-termelő neuronok bőséges előfordulását mutatták hypothalamuson kívüli agyterületeken is. Munkánk célja az extrahypothalamicus GnRH-idegsejtek karakterizálása volt.
Az immunmoduláns kezelések választásának szempontjai sclerosis multiplexben
Az elmúlt évtizedekben számos olyan immunmoduláns, illetve immunszuppresszív készítményt törzskönyveztek sclerosis multiplex (SM) kezelésére, amelyek megváltoztathatják az SM hosszú távú kimenetelét. Jelenleg relapszáló-remittáló (RR), primer progresszív (PP) és szekunder progresszív (SP) kórformák kezelése lehetséges. A RR kórforma esetén alkalmazható terápiás paletta a legszínesebb, ami olykor jelentősen megnehezíti a terápiás döntést.
Malignus meningeomák szisztémás kezelésének lehetőségei
A malignus meningeomák az összes meningeoma 10-15%-át alkotják. Rendkívül kevés információ áll rendelkezésünkre arról, hogy milyen szisztémás kezeléssel érhetünk el érdemi eredményt rekurrens vagy irreszekábilis esetekben. Amennyiben az ilyen meningeomák esetében a sugárterápia semmilyen formája nem jön szóba, elsősorban célzott terápiák javasolhatók. Érdemes lehet a kezelés előtt mintát venni molekuláris vizsgálatok céljából, melyek alapján a kezelés részben tervezhető, valamint ezek a markerek prognosztikai markerként is használhatók, például a VEGFR2, a PDGFR, az EGFR, a hormonreceptorok közül az ER, a PR, a szomatosztatinreceptor merül fel.
Neurogenetikai betegségek innovatív kezelési lehetőségei
A molekuláris biológiai technológiáknak köszönhetően az elmúlt években számos neurogenetikai betegség patofiziológiájának és genetikai hátterének megértésében igen gyors előrelépésnek lehettünk a szemtanúi. Ehhez hasonló forradalmi fejlődésnek lehettünk a szemtanúi a gyógyszeriparban, különös tekintettel az árva gyógyszerek területén is. Ez a terápiás forradalom nem várt reményeket váltott valóra a neurogenetikai betegségekben szenvedők és kezelő orvosaik számára is. Ma már a gyógyszerpiac igen jelentős részét teszik ki az árva gyógyszerek.
A pajzsmirigyhormon-háztartás idegrendszeri szabályozása hypothyreosis T4-monoterápiája során
A pajzsmirigyhormonok a sejtműködés alapvető fontosságú szabályozói, hatásuk szinte minden szervrendszerben tetten érhető. Az idegrendszer fejlődése és működése is nagymértékben függ a pajzsmirigyhomon-jelátvitel megfelelő szintjétől. A pajzsmirigyhomon-háztartás egyik fő szabályozó köre a hypothalamus-hypophysis-pajzsmirigy tengely, ami elsősorban a vér keringő pajzsmirigyhomon szintjére képes hatni. Az egyes szövetek pajzsmirigyormon elérhetőségeit viszont egy sejttípus-specifikus, összetett szabályozórendszer állítja be az adott sejt/szövet adott pillanatban szükséges igényeinek megfelelően.
A vékonybél-adenocarcinoma gyógyszeres kezelésének új lehetőségei
A vékonybél-adenocarcinoma (SBA) ritka és rossz prognózisú daganat, az incidencia az utóbbi évtizedekben folyamatosan romló tendenciát mutat. A lokalizált betegség kezelésének alapja a műtét. Az optimális adjuváns és palliatív szisztémás terápiát megalapozó prospektív vizsgálati eredmények híján az SBA gyógyszeres kezelése a colorectalis carcinoma (CRC) kezelési protokollok alkalmazására épült. Azonban a jelenleg folyamatosan bővülő genetikai és molekuláris vizsgálati adatok az egyéb gastrointestinalis daganatoktól eltérő profilra utalnak, és másfajta terápiás megközelítést kívánnak. Jelen közlemény célja áttekintést adni a jelenlegi adjuváns és palliatív kezelési lehetőségekről, a potenciálisan célozható genetikai eltérések, jelátviteli útvonalak legfrissebb kutatási eredményeiről, ezek mentén a legígéretesebb, zajló klinikai vizsgálatokról, amelyek remélhetően alapvetően bővítik az SBA gyógyszeres kezelésének armamentumát.
1.
2.
3.
4.
5.
1.
2.
Ideggyógyászati Szemle Proceedings
A Magyar Stroke Társaság XVIII. Kongresszusa és a Magyar Neuroszonológiai Társaság XV. Konferenciája. Absztraktfüzet3.
4.
5.
Egészségpolitika
A MOK és a MOSZ további lépéseket tesz a szakma és a biztonságos betegellátás érdekében