Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 287
Az immunrendszer öregedése
Az elmúlt évtizedben megtudtuk, hogy az öregedést mind az osztódó, mind a nem osztódó sejtekben az epigenetikai információk változásai kísérik, ez az immunrendszer különböző sejtjeire, illetve magára az immunválaszra is igaz. Az epigenetikai változások különböző szinteken fordulnak elő, ideértve a hiszton poszttranszlációs módosítá- sainak és a DNS metilációjának megváltozott mintáit és a megváltozott nem kódoló RNS- (például mikro-RNS-) expressziót, a telomeráz/telomer rendszer változásait és az autofágia szintjének módosulását az öregedés során. Az egészséges immunválaszban a memória-T- és -B-sejtek szintjének immungerontológiai változása mögött álló epigenetikai változásokról is új adatokat tudtunk meg. Ide tartozik a Covid-járvány első három hullámában kimutatott, életkorfüggő citokinvihar jelensége is. Meglepő módon, bizonyos típusú epigenetikai információk transzgenerációs módon működhetnek, és befolyásolják az utódok élettartamát. Ez azt jelenti, hogy a kizárólagos genetikai meghatározottság helyett az immunválasz elsősorban epigenetikailag meghatározott; az étrend és más környezeti hatások (fertőzések, gyógyszerek) az epigenetikai információk megváltoztatásával befolyásolhatják az immunválasz időtartamát. Az utóbbi nagyon lényeges a vakcinák védőhatásának időtartamát illetően is.
Neuroborreliosis által okozott kisérvasculitis diagnózisa és komplex kezelése
Bevezetés: A neuroborreliosis a Lyme-kór korai vagy késői szövődménye, ami a fertőzöttek 10-15%-ában alakul ki a B. burgdorferi hematogén vagy közvetlenül a perifériás, illetve agyidegek mentén történő terjedése révén. A korai stádiumban lymphocytás meningitis, agyidegtünetek, polyradiculopathia, a késői stádiumban myelitis, ritkán encephalitis jelentkezhet. Központi idegrendszeri vasculitis a fertőzöttek 0,3–1%-ában alakul ki, jellemzően a vertebrobasilaris rendszerben. Főként a nagy, de ritkán a kisereket is érinti. Szekunder profilaxisként célzott antibiotikum-terápia alkalmazandó, ezért fontos a fertőzés kimutatása. Módszer: Egy 52 éves férfi beteg esetét mutatjuk be, aki hirtelen kialakult dysarthria, poliglott aphasia, járási és törzsataxia miatt jelentkezett kivizsgálásra. A koponya- MR-vizsgálat által igazolt multiplex ischaemiás laesiók lokalizációja, valamint az emelkedett liquorösszfehérje alapján felmerült kisérvasculitis lehetősége. A beteg állapota egy héten belül romlott, a kontroll-MR-vizsgálat a laesiók számának jelentős növekedését igazolta. HIV, HBV, HCV, HSV1, VZV, Borrelia, lues szűrővizsgálatokat végeztünk, illetve szisztémás autoimmun betegségekben megjelenő autoantitesteket vizsgáltunk (ANA, ANCA, anti-SSA, anti-SSB, anti-DNS, anti-Scl-70, anti- Jo-1, anti-Sm, anti-beta-2-glikoprotein, anti-cardiolipin). B. burgdorferi elleni antitest jelenlétét igazoltunk a szérumban és a liquorban. A liquor-/szérumantitest arány intrathecalis antitestképzést bizonyított. (A többi vizsgálat negatív eredménnyel zárult.) A beteget a terápiás protokollnak megfelelően iv. ceftriaxonnal kezeltük. A beteg állapota a kezelés után tovább romlott, az ismételten elvégzett kontroll-koponya-MR a laesiók számának és méretének progresszióját igazolta. Ekkor immunológus bevonásával per os szteroid- és azathioprinkezelést kezdtünk. A kontroll-MR-vizsgálatok további progressziót igazoltak, ezért rituximabra váltottunk, mely mellett a beteg állapota klinikailag javult, a képalkotó vizsgálatok újabb laesiókat nem mutattak ki. Eredmények: A fenti vizsgálatok alapján neuroborreliosissal összefüggésbe hozható kisérvasculitist állapítottunk meg. Következtetés: Tekintettel arra, hogy a betegség a célzott antibiotikum-kezelést követően is progrediált, felvetjük parainfekciózus immunmediált patomechanizmus lehetőségét.
NMDAR-encephalitissel átfedő demyelinisatiós szindróma – diagnosztikai és terápiás kérdések
Az anti-N-metil-D-aszpartát-receptor (NMDAR-) encephalitis az NMDAR GluN1 alegysége elleni IgGantitestekkel társuló autoimmun kórkép. A tünetek súlyossága ellenére csak a betegek 35%-ánál mutatható ki koponya-MRI-vel károsodás, ami leggyakrabban monofázisos formában fordul elő. A legfrissebb adatok alapján azonban az anti-NMDAR encephalitisben szenvedők kis százalékánál további relapszusok jelentkezhetnek, melyek hátterében demyelinisatiós laesiók mutathatók ki. A szakirodalomban egyre több adat lelhető fel, miszerint az NMDAR-encephalitis átfedést mutathat más autoimmum, demyelinisatiós kórképpel, leggyakrabban neuromyelitis optica spektrum betegséggel (főként anti- MOG ellenanyag-pozitív estekben), ritkábban sclerosis multiplexszel. A felmerülő diagnosztikai nehézségeket egy eset kapcsán mutatjuk be. A 24 éves férfi pszichiátriai beutalást követően 2 hónapos tünetkezdetet követően először 2014 májusában került felvételre a Neurológiai Klinikára memóriazavar, bal oldali latens hemiparesis kivizsgálása céljából. Akkor készült koponya-MRI-n disszeminált, gócos agyi folyamat ábrázolódott, gyűrűszerű kontrasztanyag-halmozással, kétoldali hippocampus-érintettséggel. A látott kép leginkább ADEM-nek felelt meg. A liquorban oligoklonális gammopathia látszott. A virális és paraneoplasiás eredetet kizártuk. Intravénás szteroidterápiára átmeneti javulás jelentkezett, azonban a terápia leépítését követően ismételt állapotrosszabbodás következett be. A szteroidterápia ismétlése érdemi változást nem hozott, plazmaferézisben részesült, azathioprinterápiát kapott. A diagnosztikai vizsgálatok során az ellenanyag-vizsgálat alapján anti- NMDAR encephalitis diagnózist állítottuk fel. PET CTvel követtük 3 évig. Állapota stagnált, koponya-MRI-n sem jelent meg új laesio, kifejezett jobb oldali hippocampalis atrophia látszott. Imuran elhagyását követően 2 évvel kettős látása jelentkezett, koponya-MRI-vizsgálaton novum fehérállományi laesiók jelentek meg. A látott radiológiai kép és a korábbi liquorlelet, valamint a klinikum alapján felmerült sclerosis multiplex lehető- sége, intravénás nagy dózisú szteroidterápiát alkalmaztunk. Szérum-aquaporin-4, anti-MOG, anti-NMDAR ellenanyag- vizsgálat a szteroidterápiát követően készült, negatív eredményt adott. A szakirodalmat részletesen áttekintve az anti-MOG ellenanyag-pozitív NMO szövődik leggyakrabban az NMDA-R encephalitisszel átfedő demyelinisatiós szindrómával, a sclerosis multiplex ettől jóval ritkább. A közös hatékony terápiás opció a rituximab, aminek támogatását kérvényeztük.
Klinikum
2021. SZEPTEMBER 09.
Klinikai vizsgálatokról
A klinikai vizsgálatok célja megtalálni a betegségek megelőzésének, diagnosztikájának vagy kezelésének megfelelő módját. A kezelést tekintve a klinikai vizsgálatok célja gyakran annak megállapítása, hogy az új kezelés hatásosabb és kevesebb mellékhatással jár, mint más, már a gyakorlatban használt eljárás. A klinikai vizsgálatokat a félig-kísérletek közé sorolják és akár több vizsgálat együttes kiértékelésére is szükség lehet az eredmények általánosításához (metaanalízis, evidence synthesis).
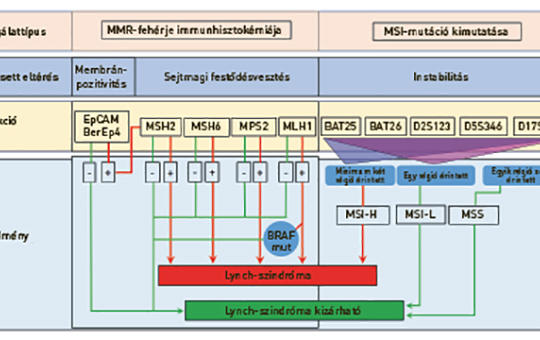
Mikroszatelliták mint a genom „szeizmográfjai”
A genetikai állomány fehérjét nem kódoló, monotonon ismétlődő, 1–6 nukleotidot tartalmazó szakaszain, a mikroszatellitákon a DNS-kettőződésért felelős polimerázok könnyen hibáznak. Így azok rövidülnek vagy hosszabbak lesznek. Ha az ilyen típusú DNS-hibákat javító enzimek működőképesek, a mutációk kijavítódnak. Ha nem, akkor különböző hosszúságú szakaszokként, instabil formában adódnak át az utódsejtekbe. Nemcsak korán jelzik a fokozott mutációs hajlamot, hanem önmagukban is, keretleolvasási problémát okozva, továbbiakat generálnak. Következésképpen a mikroszatellita-instabil (MSI) daganatok nagyobb arányban fejeznek ki idegen antigéneket, mint ezen eltérést nem mutatók, ami a tumorellenes immunválasz fokozott hatékonyságát valószínűsíti. Az MSI tehát nemcsak a genetikai instabilitásra, hanem az immunellenőrzőpont-gátló szerek hatásosságára is utal. Jelenlétét lehet közvetlenül, nukleotidfelbontási szintű PCR-alapú eljárással vagy közvetve, a hibajavító fehérjék kimutatásával, immunhisztokémiával vizsgálni, de ma már új generációs szekvenálási adatokból és mesterséges intelligencia képi elemzésből is kinyerhetők ilyen információk. Az MSI-meghatározás módszertanát és klinikai jelentőségét foglaljuk össze.
Gyerekek és gyermekeket várók, tervezők – szabad-e oltani?
Úgy tűnik ebben a hazai álláspont egyértelmű, de számos országban már kismamákat oltanak. A jelenlegi szakértői vélemények szerint az mRNS-oltások nem veszélyesek a terhes kismamákra, de klinikai kísérletek hiányában ezt mégsem lehet százszázalékos biztonsággal állítani. Magyarországon éppen ezért nem ajánlják az oltást várandósoknak, de az Egyesült Államokban, Izraelben, vagy Angliában a kismamákra bízzák a döntést. Gyermekeknek egyelőre sehol sem adnak vakcinát.
Praxisközösségben dolgozó gyógyszerészek gyógyszer-optimalizációs hatása
Az Egyesült Királyságban végzett multicentrikus, randomizált, kontrollált vizsgálat értékelte a családorvosi praxisközösségben dolgozó gyógyszerészek által végzett gyógyszerelési optimalizáció hatását a mellékhatások és az egészségügyi kiadások csökkenésére, továbbá a betegkimenetek javulására.
miRNS-alapú terápiák idegrendszeri betegségekben: lehetőségek és kihívások
22 évvel azután, hogy kiderült: bármely gén elcsendesíthető, tucatnyi klinikai vizsgálat elemzi a miRNS-mimetikumok és -inhibitorok terápiás hatását. A módszert az idegrendszeri betegségek közül a neurodegeneratív kórképek, az epilepszia, az agytumorok és a cerebrális ischaemia kezelésében vizsgálják.
Veszélyben az egyetemek autonómiája?
Tiltakozó közleményekkel „szavaznak” sorra az egyetemek az alapítványi átalakítás, illetve annak intézési módja ellen. Professzorok, munkatársak, hallgatók, legutóbb az MTA doktorai adtak ki hivatalos állásfoglalást. Megkérdeztünk „kívülállókat”, Freund Tamást, az MTA elnökét, Tillmann József filozófus, esztéta, egyetemi tanárt, Fleck Zoltán jogász, szociológust, tanszékvezető egyetemi tanárt a kialakult helyzetről, a folyamatról, illetve Fábián Istvánt, a debreceni egyetem korábbi rektorát is. Többen a tudományos és kutatómunka, az egyetemi autonómia ellehetetlenülésétől félnek, veszélyes ugyanis, ha ezek a szellemi műhelyek politikai irányítás alá kerülnek. Az MTA elnöke kiemelte az egyetemi autonómia tiszteletben tartásának és a döntések előtti tisztázó vitáknak a fontosságát.
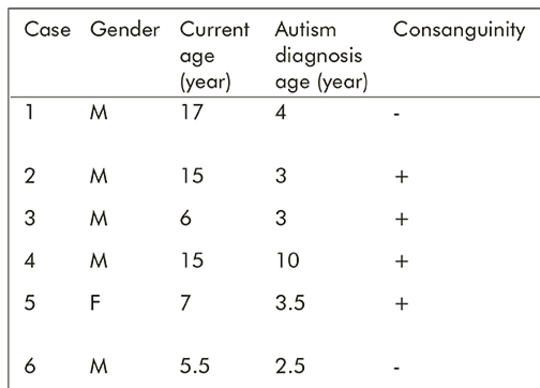
[Veleszületett metabolikus rendellenességgel diagnosztizált autista gyermekek]
[Az autizmus spektrum zavar heterogén tünetekkel jelentkező idegrendszeri fejlődési zavar, aminek az etiológiája nem kellően tisztázott. A közelmúltban, az autizmus gyakoriságának növekedése és a veleszületett metabolikus rendellenességek diagnosztikai lehetőségeinek bővülése miatt egyre több komorbiditásra is fény derült. A vizsgálatban olyan autizmus spektrum zavar diagnózissal rendelkező betegek vettek részt, akik 2018. szeptember 1. és 2020. február 29. között a Gyermekbetegek Metabolizmusambulanciáján részesültek ellátásban (n = 179 fő). A betegek személyes adatait, rutin és speciális metabolikus teszteredményeit retrospektív módon elemeztük. Az ambulanciánkon ezen idő alatt megjelent 3261 beteg közül 179-en (5,48%) rendelkeztek autizmus spektrum zavar diagnózissal, ők képezik vizsgálatunk betegpopulációját. A speciális metabolikus kivizsgálás eredményeképpen 6 beteg (3,3%) esetében állítottunk fel veleszületett metabolikus rendellenesség diagnózist. Két betegünk klasszikus phenylketonuria, két betegünk klasszikus homocystinuria, egy betegünk 3D típusú mucopolysaccharidosis (Sanfilippo-szindróma) és egy 3-metilkrotonil-CoA-karboxiláz-hiány diagnózist kapott. A veleszületett metabolikus rendellenesség ritkán autizmus spektrum zavarhoz társulhat. A kór-történet pontos felvétele, az alapos fizikális vizsgálat és a tünetek gondos mérlegelése az autizmus spektrum zavarban szenvedő betegek esetében segítheti a klinikust a döntéshozatali folyamatban, és elvezethet a megfelelő metabolikus kivizsgáláshoz. Ha az autizmus hátterében veleszületett metabolikus rendellenességet találunk, az hatékony kezelést eredményezhet.]
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.