Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Magyar Immunológia - 2004;3(04)
Tartalom
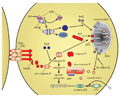
A rheumatoid arthritis lehetséges kezelése: géntranszferindukált apoptózis
A génterápiát eredetileg elsõdlegesen olyan betegek kezelésére fejlesztették ki, akiknek valamilyen géndefektusuk van, és a hiányzó gént pótolják ezzel az eljárással. Késõbb az indikációs kört géntranszfer formájában kiterjesztették, ami bizonyos betegségek kezelésére alkalmas gének bevitelét jelenti. Ez utóbbi eljárás bevezetésre került rheumatoid arthritisben is, ahol a génterápiának számos elõnye lehet más eljárásokkal szemben.
Immunológiai változások idõskorban
Az „immunosenescence” (immunöregedés) az immunrendszer átalakulását jelenti a kor elõrehaladtával párhuzamosan. Az immunrendszer öregedése fiziológiás folyamat, hátterében komplex immunregulációs változások állnak, amelyek az idõsek esetében gyakrabban kialakuló infekciók, malignus folyamatok, valamint autoimmun betegségek alapjául szolgálnak. Fontos azonban elkülöníteni az elsõdlegesen (élettani) és a másodlagosan létrejövõ (betegségek okozta) immunológiai változásokat.
A Felty-szindróma immunológiája
A Felty-szindróma szuperreumatoid betegségnek fogható fel, amely immungenetikailag sokkal egységesebb kórkép, mint a rheumatoid arthritis. A HLA-DRB1*0401 antigén az esetek 83%-ában megtalálható. Általában a rheumatoid arthritis hosszabb lefolyása során jelentkezik, a szakirodalmi adatok szerint az esetek 1%-ában. Ha a rheumatoid arthritisben szenvedõ betegnek tartós, más okkal nem magyarázható neutropeniája van, Feltyszindróma diagnosztizálható akkor is, ha splenomegalia nem mutatható ki.
Aktivált T-sejtek vizsgálata non-Hodgkin-lymphomás betegek esetében
Az immunrendszer számos mechanizmusa révén próbál a szervezetben kifejlõdõ malignus sejtklónok ellen védekezni, amelyek közül talán a legjelentõsebb a T-sejtes immunválasz. Valamennyi (CD4+ helper és CD8+ citotoxikus) T-sejt fontos aktivációs markere a sejtfelszíni CD69 és az MHC II. családba tartozó HLA-DR molekula.
Õszi nemzetközi kongresszusok, 2004
Korábbi gyakorlatomhoz híven, ismét két nemzetközi kongresszusról számolok be, amelyek 2004. október-novemberében zajlottak.
Az immunológia kezdetei Magyarországon 5. rész
Az allergia (Pirquet, 1903), anaphylaxia (Richet 1902), Arthus-fenomén (1903), Th. Smith-jelenség (1904) megismerése magyarázattal szolgált az allergiás diagnosztikai próbák, valamint a szérumbetegség, majd több más hasonló alapokon fejlõdõ kórkép kialakulására.
1.
2.
3.
4.
5.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
A Magyar Stroke Társaság XVIII. Kongresszusa és a Magyar Neuroszonológiai Társaság XV. Konferenciája. Absztraktfüzet5.