Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 83
Kihívások a TKI-terápiákra rezisztens vagy intoleráns CML betegek kezelésében
A krónikus myeloid leukaemia (CML) myeloproliferativ neoplasia, amelynek incidenciája 1–2 eset/100 000 felnőtt. Az újonnan diagnosztizált felnőttkori leukaemiák körülbelül 15%-át teszi ki (1). A CML terápiás fegyvertára nagymértékben bővült a ...
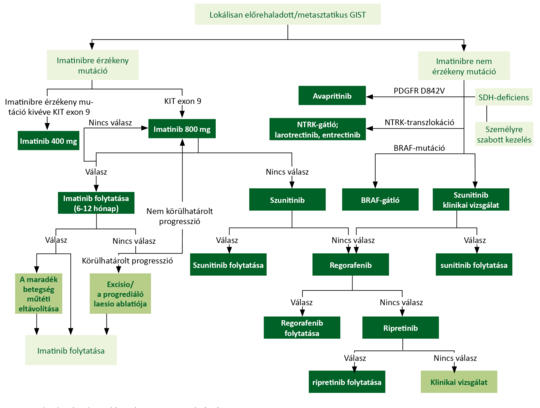
A GASTROINTESTINALIS STROMATUMOR GYÓGYSZERES KEZELÉSE
Az előrehaladott stádiumú gastrointestinalis stromatumorban (GIST) szenvedő betegek életkilátásai kimondottan rosszak voltak a tirozinkináz-gátlók (TKI) bevezetését megelőző időszakban. Az imatinib, szunitinib és később a regorafenib bevezetésével a betegek túlélése lényegesen javult.
Előrehaladott vesesejtes rák kombinált immunterápiás klinikai vizsgálata (ARCITECT; HCRN GU 22-587)
A metasztatikus tiszta sejtes vesesejtes karcinómában (mccRCC) szenvedő betegek első vonalbeli kezelése gyakran tartalmaz anti-PD1-gátlót anti-CTLA-gátlóval (IO/IO) vagy VEGF-receptort tirozinkináz-gátlóval (TKI) kombinálva (IO/TKI).
A Richter megvásárolja a BCI Pharma vállalatot
A Richter felvásárolt egy belgiumi székhelyű, a kináz kutatásában jelentős eredményeket elérő biotechnológiai vállalatot, melynek értéke 12 millió eurót tesz ki.
Hagyományos és modern gyógyszerterápiás lehetőségek a malignus primer csonttumorok kezelésében
A primer malignus csontdaganatok előfordulása ritka, az összes rosszindulatú megbetegedés mindössze 0,2%-áért felelősek.
Sejtterápiás megközelítések a malignus lymphomák gyógyításában
Az immuno-kemoterápiák és/vagy Bruton-féle tirozinkináz-gátlók, valamint a sporadikusan alkalmazott célzott terápiák alkalmazása után visszaeső vagy refrakteritást mutató B-sejtes malignus lymphomák hatékony kezelése megoldatlan. Ezen a területen jelent új és hatásos terápiás lehetőséget a T-sejtes tumorellenes válasz direkt módon történő aktiválása. Erre alkalmasak lehetnek a genetikailag módosított, kiméra-T-sejt-receptort hordozó CAR-T sejtek.
A vesecarcinoma első vonalas kezelésének lehetőségei, korai tapasztalatok az immun-immun kombinációval
Az előrehaladott és áttétes vesedaganatok kezelése az onkológia dinamikusan változó területe. Az első célzott terápiás készítmény törzskönyvezése óta (2005) szinte évente került sor újabb és újabb készítmények regisztrálására. Az immunellenőrzőpont-gátlók kifejlesztése és az ellátási algoritmusokba való illesztése (2015) tovább bővítette a terápiás palettát. Mindezek ellenére a különböző terápiás vonalakban alkalmazott készítmények kiválasztása sokszor kihívás elé állítja a klinikusokat. A cikkben az első vonalbeli kezelések kerültek összefoglalásra.
A krónikus myeloid leukaemia kezelésének aktualitásai
A krónikus myeloid leukaemia a tirozinkináz-gátló kezelések megjelenése óta halálos betegségből jól kezelhető, krónikus kórképpé vált. A betegség alapját a Philadelphia-kromoszóma kialakulása és a konstitutívan aktív BCR-ABL1 tirozinkináz keletkezése okozza. A tirozinkináz-gátlók alkalmazása mellett a krónikus fázisú CML-es betegek életkilátásai ma már megközelítik a normálpopulációét.
Fázis 2b klinikai vizsgálat a tolebrutinib (orális, központi idegrendszerbe penetráló BTK-inhibitor) biztonságosságának és hatékonyságának meghatározására
A sclerosis multiplex kezelésére ez idáig törzskönyvezett immunmoduláns készítmények jó hatásfokkal csökkentik a betegség során végbemenő akut gyulladásos folyamatokat, a hosszú távú progresszióért nagyobb részben felelős krónikus gyulladásos folyamatokra gyakorolt hatásuk azonban csekélyebb mértékű vagy kevésbé tisztázott. A Bruton-féle tirozinkináz (BTK) egy intracelluláris szabályozófehérje, amely több B-sejt érési és aktivációs jelátviteli útvonal fontos résztvevője, emellett a myeloid sejtek (macrophagok, microglia) működésében is lényeges szerepet tölt be. A tolebrutinibbel végzett fázis I klinikai vizsgálatok során per os alkalmazás mellett a liquorban is farmakológiailag releváns koncentráció alakult ki. A fentiek alapján lehetséges, hogy a tolebrutinib sclerosis multiplexben nemcsak az aktív gyulladásos folyamatok, hanem a tartós progressziót eredményező, zárt vér-agy gát mögött zajló, részben a natív immunitás sejtjei által fenntartott krónikus gyulladásos jelenségek (krónikus aktív laesiók, meningealis folliculusok) kezelésében is hatékony lehet.
RET-módosult rákok precíziós terápiája RET-gátlókkal
A RET részt vesz egyes szervrendszerek élettani fejlődésében. A RET-módosulások akár génfúziók vagy akár pontmutációk révén történő aktiválása erős onkogén driver a nem kissejtes tüdőrákban, a pajzsmirigyrákban és különböző egyéb rákos megbetegedésekben. RET-módosult daganatokat kezdetben multikináz-inhibitorokkal (MKI) kezelték. Az MKI-k hatékonysága szerény volt, toxicitásuk pedig jelentős az off-target aktivitásuk miatt. A közelmúltban a rendkívül erős és RET-specifikus inhibitorok, a szelpercatinib és a pralszetinib sikeresen átkerültek a klinikai gyakorlatba és az FDA jóváhagyta ezeket a készítményeket. Összefoglaljuk a jelenlegi legmodernebb terápiás módszereket ezen új RET-gátlók preklinikai és klinikai adatainak és a szerzett rezisztenciamechanizmusok, valamint a jövőbeli kilátások áttekintésével.
1.
2.
3.
4.
5.
1.
2.
Ideggyógyászati Szemle Proceedings
A Magyar Stroke Társaság XVIII. Kongresszusa és a Magyar Neuroszonológiai Társaság XV. Konferenciája. Absztraktfüzet3.
4.
5.
Egészségpolitika
A MOK és a MOSZ további lépéseket tesz a szakma és a biztonságos betegellátás érdekében