Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 269
A méhnyakrák korszerű onkológiai kezelése
Világszerte évente több mint félmillió nőnél igazolódik méhnyakrák, és körülbelül 300 000 halálesetet okoz a betegség. A nyugati társadalmakban a cervixcarcinoma incidenciája és mortalitása csökken a humán papilloma vírus (HPV) elleni vakcinációnak és a populációs szintű szűrésnek köszönhetően. A fejlődő világ országaiban azonban továbbra is emelkedő a tendencia. A rákmegelőző állapotok és a korai méhnyakrák definitív onkológiai ellátása a stádiumfüggő kiterjesztéssel végzett műtétek révén lehetséges. A posztoperatív sugárkezelés vagy kemoradioterápia szükségessége a patológiai rizikófaktorok alapján határozható meg. Előrehaladott méhnyakrákban a definitív kemoradioterápia vagy a szisztémás kezelés a terápiás alternatívák. A fiatal betegek részéről gyakran felmerülő kívánság a fertilitásmegtartás, amely az onkológiai elvekkel csak jól definiált határok között egyeztethető össze, alapos felvilágosítást követően. A terhesség alatt felismert méhnyakrák becsült incidenciája 1,4-4,6 eset/100 000 szülés, amelynek ellátása során, az onkológiai szempontokon túl, a magzat biztonságát is szem előtt kell tartanunk az anya preferenciái alapján. A klasszikus kemoterápia mellett a biológiai szerek is megjelentek a közelmúltban a méhnyakrák szisztémás kezelési lehetőségei között: első vonalban bevacizumabbal egészíthető ki a ciszplatin-paclitaxel kombináció közel négy hónapos túlélési előnyt nyújtva a betegek számára; míg másodvonalban pembrolizumab adható mikroszatellita-instabil vagy PDL-1-et expresszáló (combined positive score [CPS] ≥1), illetve magas tumormutációs terheltséget (TMB ≥10) mutató daganatok esetén. A jelen munka egy rövid összefoglalót szolgáltat a méhnyakrák megelőzéséről, kivizsgálásáról és onkológiai ellátásáról.
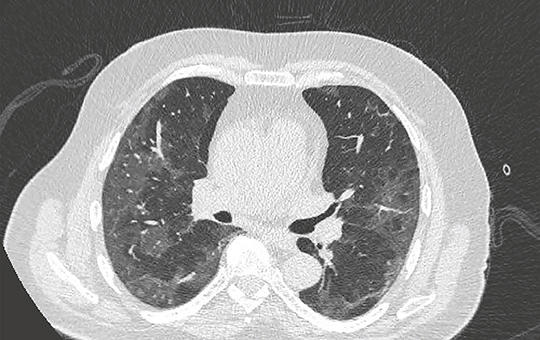
SARS-CoV-2 fertőzés okozta tüdőkárosodás. Tüdőrák és a Covid-19 a TERAVOLT vizsgálat tükrében
A Covid-19-járvány remélhetőleg vége felé, cikkünkben rövid áttekintést kívánunk adni a fertőzésről, a kórokozóról, a második hullám végére kialakult hatékonynak tűnő kezelési lehetőségekről, a tüdőkárosodásról és a TERAVOLT klinikai vizsgálatról, amely összefoglalja tüdőrákban szenvedő, kezelést kapó és/vagy nem kapó SARS-CoV-2 vírussal fertőződött betegek életkilátásait, a diagnosztika területén létrejött szabályokat (bronchoszkópia, mellkasröntgen, mellkasi CT), és néhány szóban a védőoltásokról is szó esik. A szerzők rövid áttekintést adnak a légzőszervi és daganatos betegek fertőzés alatti kezeléséről, az inhalációs készítmények, immunterápia, kemoterápia folytathatóságáról.
miRNS-alapú terápiák idegrendszeri betegségekben: lehetőségek és kihívások
22 évvel azután, hogy kiderült: bármely gén elcsendesíthető, tucatnyi klinikai vizsgálat elemzi a miRNS-mimetikumok és -inhibitorok terápiás hatását. A módszert az idegrendszeri betegségek közül a neurodegeneratív kórképek, az epilepszia, az agytumorok és a cerebrális ischaemia kezelésében vizsgálják.
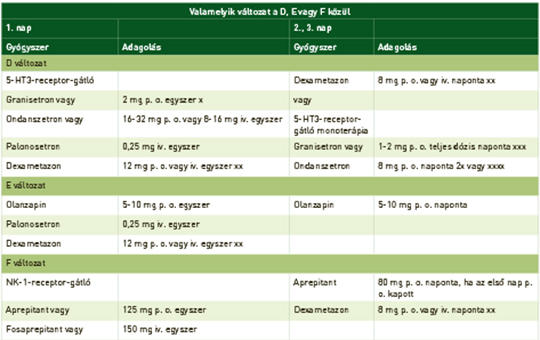
Hányáscsillapítás az onkológiai kezelések során
A hányinger és hányás egy többlépcsős folyamat, amely a központi idegrendszer irányítása alatt áll. A hányást kiváltó ingerek pszichés hatásra az agykéreg felől érkezhetnek vagy a nervus vaguson keresztül. A nyúltvelőben speciális magvak találhatók, amelyek a hányást kiváltják. Legfontosabb ingerületátvivő anyagok a szerotonin, a P-anyag és a dopaminok. A kemoterápiás szerek különböző arányban okoznak hányingert és hányást. Az 5-HT3- és NK-1-receptor-antagonisták a legjelentősebb hányinger-csillapítók. Szakmai ajánlások javasolják a gyógyszer-kombinációkat a különböző kemoterápiák okozta hányás csillapítására. A fix, szájon keresztül alkalmazható kombináció: netupitant és palonosetron (NEPA) növeli a betegek terápiahűségét. Az összefoglaló kitér a speciális hányingerek és hányások ismertetésére: áttöréses, többnapos kemoterápia okozta, sugárterápia során kialakult és a megelőlegezett hányásokra, valamint a gyermekkori hányáscsillapítás problematikájára is.
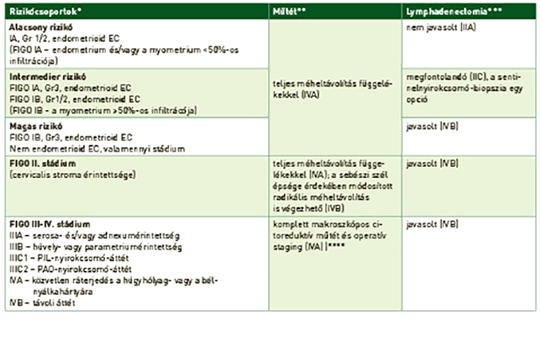
A méh rosszindulatú daganatainak korszerű onkológiai kezelése
Világviszonylatban évente közel 400 000 nőnél igazolódik méhtestrák, amely 2018-ban körülbelül 90 000 nő halálát okozta. Az esetek túlnyomó részét a méhnyálkahártya hormonérzékeny hámjából kiinduló endometriumcarcinomák (EC) alkotják. A sarcomák a méhtestrákok alig 3%-át adják. Az EC-k 80-85%-a jó prognózisú, mivel alacsony gradusú és korai stádiumban kerül felismerésre, amikor a műtét és az esetleges posztoperatív kezelés révén a gyógyulás reális terápiás cél. Az előrehaladott stádiumban diagnosztizált EC és a nem endometrioid altípusok esetén a prognózis lényegesen rosszabb. A magas rizikójú EC optimális adjuváns kezelésére irányuló vizsgálatok egy része még folyamatban van, illetve a bővülő molekuláris ismeretek újabb vizsgálatokat generálnak. A méhtestsarcomák esetében is a sebészi eltávolítás jelenthet kuratív megoldást, az adjuváns kezelésre vonatkozó evidenciák bizonytalanok, egyéni mérlegelést igényelnek. A modern onkoterápia érájában már nemcsak a betegségmentes élet meghosszabbítására, hanem az élet minőségének minél teljesebb megőrzésére is törekszünk. A nőgyógyászati onkológiában ezt jelenti a fertilitás vagy a funkcionáló ováriumok lehetőség szerinti megőrzése; a magas morbiditással járó szisztémás lymphadenectomia indikációs körének szűkítése; a kedvezőbb mellékhatásprofilú brachytherapia alkalmazása a teljes kismedencei besugárzás helyett. A modern onkoterápia az úgynevezett biológiai kezelések által az előrehaladott betegségek ellátásának is a részévé vált: kemoterápia mellett/után progrediáló esetekben a pembrolizumab az EC és a sarcomák esetén is alkalmazható mikroszatellita-instabilitás vagy magas tumormutációs terheltség esetén, míg az NTRK fúziós gén jelenlétében larotrectinib vagy entrectinib mint célzott tirozinkináz-gátlók javasolhatók. Az EC-k 70-80%-át kitevő mikroszatellita-stabil esetekben (nem endometrioid altípusokban is!) a pembrolizumab lenvatinibbel kombinációban adható a kemoterápia után. Az EC területén gyarapodnak továbbá az egyéb célzott terápiás szerekkel szerzett tapasztalatok is (anti-HER2 serosus carcinomában, mTOR-gátló kezelés, endokrin terápia, más immun checkpoint inhibitorok, tirozinkináz-gátlók, PARP-gátlók és kombinációs kezelések). A jelen munka a méhtestrákok onkoterápiájáról kíván rövid összefoglalást nyújtani az aktuális szakmai ajánlások és a folyamatban lévő vizsgálatok bemutatásával.
Az onkológiai gyógyszerész táguló szerepköre
A technológiai haladás felszabadította a gyógyszerészeket, akiknek ma már nem kell a gyógyszerkiadás biztonsági ellenőrzésére fókuszálniuk, és egyre több betegágy melletti feladatot is vállalhatnak, részt vehetnek akár az őssejttranszplantáció kivitelezésében vagy a farmakogenomikai eredmények értelmezésében is.
Esettanulmány a koronavírus-járvány kezelési lehetőségeiről 2020 tavaszán a budapesti Olajág Idősek Otthonában
A SARS-CoV-2 okozta Covid-19-világjárványban az idősotthonokban élők különösen veszélyeztetettek voltak. Jelen tanulmányban a szerzők Budapesten, az Olajág Otthonok Vezér utcai telephelyén kialakult lokális járvány okait és a fertőzés megfékezésének lehetőségeit elemzik. Összefoglalják azokat az intézkedéseket, amelyek a betegek elkülönítése és kezelése során hatékonynak bizonyultak. A fertőzésben megbetegedettek számát, valamint a betegség lefolyását statisztikai adatokkal demonstrálják. A szerzők kiemelten fontosnak tartják a tünetmentes, de fertőzött lakók felkutatását, a szűrővizsgálatok gyors bevezetését, a protokollok szigorú betartását, a betegutak szabályozását és a fokozott, segítő kommunikáció alkalmazását.
A fej-nyaki daganatok komplex kezelése – áttekintés
A fej-nyaki laphámsejtes daganatok (head and neck squamous cell carcinoma – HNSCC) kezelése rendkívül komplex feladat, amely megkívánja a fej-nyak sebész, sugárterápiás szakember és klinikai onkológus szoros együttműködését. Elsődleges célnak a jó tumorkontrollt kell tekintenünk, de a terápia megválasztásánál szem előtt kell tartanunk az onkológiai radikalitás mellett az elfogadható életminőséget, ismervén, hogy a legtöbb lokális terápia nagyban befolyásolja a betegek légzés-, nyelés- és/vagy beszédfunkcióját. A megfelelő diagnosztikus vizsgálatok alapján a betegséget besorolhatjuk korai stádiumba, lokálisan/regionálisan előrehaladott stádiumba, illetve távoli áttétes és/vagy kiújult stádiumba. Kategóriánként eltérő terápiás modalitások jönnek szóba, amelyeket tovább bonyolít a primer tumor, az áttétek elhelyezkedése, a beteg állapota, társbetegségei, a daganat biológiai viselkedése. Jelen áttekintő közleményben a szerzők összefoglalják a fej-nyaki laphámrákok terápiájának alapelveit.
Az immunellenőrzőpont-gátlók alkalmazása Covid-19-fertőzés során
Már 2020. március első felében látszott, hogy a daganatos betegek Covid-19-fertőzése esetén jóval nagyobb a súlyos szövődmények kockázata, mint a nem daganatos fertőzötteknél (39% vs. 8%, p = 0,0003). Ha a betegek éppen kemoterápiát kaptak, vagy éppen műtéten estek át, még magasabb volt a kockázat. Ezért a kutatók rendszerint a kemoterápia és a műtét pár napos/hetes elhalasztását javasolták például Olaszországban is, főleg a hematológiai toxicitás és az immunszuppresszió miatt.
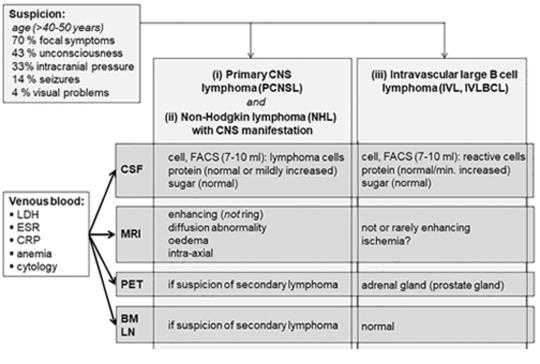
[Longitudinális extenzív transzverzális myelitisként jelentkező idegrendszeri lymphoma]
[Célkitűzés – Két, kifejezetten ritka, longitudinális extenzív transzverzális myelitisként (LETM) jelentkező, szubakut lefolyású, post mortem kórismézett, intravascularis, nagy B-sejtes, valamint szekunder T-sejtes idegrendszeri lymphoma bemutatása. A diagnosztikus problémák, a meg - tévesztő radiológiai és szövettani vizsgálatok okainak keresése, és a tennivalóink megfogalmazása ezekben a nehezen diagnosztizálható betegségekben, eseteink és másutt közölt esetek alapján. Módszer, esetismertetések – Neurológiai osztályra való felvételekor a 48 éves nő parapareticus volt, az MR-vizsgálat LETM-re utalt, de a kezelés hatástalan maradt. Pneumonia és befolyásolhatatlan polyserositis miatt ápolásának negyedik hetében meghalt. A patológiai vizsgálat intravascularis diffúz nagy B-sejtes lymphomát (IVL) derített fel. Második esetünkben, egy 61 éves férfinél fejfájás és paraparesis miatt végzett MR-vizsgálat gyulladás látszatát keltő, bitemporalis elváltozást és LETM-et állapított meg. A vizsgálatok eredménytelenek maradtak, az IVL gyanúja miatt végzett áramlásos citometria és az izombiopszia is. Mellkasi, hasi CT-vizsgálat a bal tüdőben, kis területen, gyulladásos gócos elváltozást, a jobb mellékvesében adenomát talált. Az érintett temporalis területből neuronavigációval vett minta T-sejt mediálta meningoencephalitisre utalt, diffúz nagy B-sejtes lymphoma lehetőségét kizárta. A beteg állapota fokozatosan romlott, a kórházi felvételt követő hatodik héten meghalt. A patológiai vizsgálat során a mellékvesével összefüggő, adeno - má nak vélt daganat, valamint a pancreasfarokban és a tüdőben talált elváltozás perifériás T-sejtes lymphomának bizonyult, ugyanúgy, mint az agyban és a gerincvelőben talált elváltozások. A lymphoma megtévesztően gyulladás látszatát keltette a szövettani mintákban, ugyanúgy, mint az MR-vizsgálatoknál. Következtetések – Lymphoma manifesztálódhat LETMként. Etiológiailag bizonytalan, atípusos LETM esetén, 40 évesnél idősebbeknél, eseteinkre és előzőleg közölt ese - tekre is hivatkozva, a rutinkivizsgálás részeként, hangsú - lyozottan minél hamarabb random bőrbiopszia javasolt (sub cutan zsírszövettel együtt), a comb és a has bőréből. A lelet, kiderítve az intravascularis lymphomát, megteremti az agresszív kemoterápia feltételeit. Ezzel egyidejűleg a liquoráramlási citometriás vizsgálata is javasolt. A bőrbiopszia negativitása esetén, ha lymphoma gyanúja továbbra is fennáll, mintavétel javasolt esetleges szisz té - más primer gócból (csontvelőből, nyirokcsomóból vagy mellékveséből), ha ez eredménytelen, a spinalis elváltozással rendszerint egyidejű cerebralis gócok egyikéből, az IVL, a diffúz nagy B-sejtes lymphoma, de a ritka Tsejtes lymphoma kizárására is, vagy bizonyítására.]
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.