Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 170
Mozgásszervi fájdalmak a hazai gyakorlatban – klinikai jellemzők és funkcionális összefüggéseik vizsgálata
Felmérésünk céljául a napi gyakorlatban jelentkező fájdalmak jellemzőinek (regionalitás, erősség és funkcionális következmények) a betegjellemzőkkel (nem, életkor, reumatológiai alapbetegségek, társbetegségek) való összevetését és összefüggéseik elemzését tűztük ki.
Válogatás a hálózatalapú járványterjedési modellek eredményeiből
A matematikai értelemben vett gráfok vagy hálózatok sokoldalú, szemléletes modellezési eszközt biztosítanak más tudományterületek számára, az orvostudomány számára is. Ebben a közleményben a fertőző betegségekkel kapcsolatos hálózati modelleket ismertetjük röviden. Az ismert, a tudományterület szakirodalmában meglévő eszközökön felül a fertőzési folyamatot kiválóan lehet modellezni hálózatokkal is.
Idegtudományok
2022. OKTÓBER 29.
A szkizofrénia a Homo sapiens sajátossága – a neuropszichiátriai betegségek evolúciós hátterének feltárása
A szkizofrénia valóban a modern emberben jelenhetett meg, és megjelenésének evolúciós szerepe van; a neandervölgyi agyban más lehetett a dopaminerg neurotranszmisszió szerepe, különösen a jutalom- és fájdalom-feldolgozás vonatkozásában (az ezekért felelős agyterületeken csökkent az FDOPA-felvétel a több neandervölgyi eredetű DNS-variációval rendelkező egészséges személyek egyes agyterületein).
Hírvilág
2022. OKTÓBER 05.
Svante Pääbo DNS-kulcsot adott a bennünk élő neandervölgyihez
Svante Pääbo munkássága és a paleogenomika tudománya nélkül nem derült volna fény arra, hogy minden mai ember DNS-ében kimutatható a neandervölgyi örökség – mondta Viola Bence, a Torontói Egyetem antropológia tanszékének professzora az MTI-nek annak kapcsán, hogy az evolúciós genetika területén elért eredményeiért a svéd genetikus kapta az idei orvosi-élettani Nobel-díjat.
Precíziós medicina alkalmazása a sugárterápiában
A sugárterápia, mint eliminatív kezelés, fontos elemét alkotja a komplex tumorellenes terápiáknak. Már a kezdetektől az adott beteg anatómiájára, a tumor típusára alkalmazott, személyre szabott eljárásként fejlődött. A technológiai előrehaladás és a kutatási eredmények nyomán az utóbbi évtizedekben lehetővé vált az egyre pontosabb céltérfogat-kijelölés és az egyre szelektívebb dózisleadás. A sugárterápiában a precíziós orvoslás korában a technológiavezérelt kezelések, beleértve a fejlett képvezérlést és a részecsketerápiát, továbbá az új biológiai koncepciók bevezetése nagyságrendileg javíthatja a terápiás indexet, a tumorpusztító és az ép szövetet védő hatás arányát. Az egyedileg kijelölt tumor- és normálszövet, illetve az egyes szövetrészek sugárérzékenységi paramétereinek meghatározása, a várható hatások előrejelzése, követése jelenti a korszerű precíziós onkoradiológiát. Közleményünkben célul tűztük ki a különböző genomikai, radiomikai és funkcionális vizsgálatoknak, valamint a korszerű informatika segítségével feldolgozott adathalmazoknak a személyre szabott sugárterápia tervezésében, adaptálásában történő felhasználásának bemutatását.
A vékonybél-adenocarcinoma gyógyszeres kezelésének új lehetőségei
A vékonybél-adenocarcinoma (SBA) ritka és rossz prognózisú daganat, az incidencia az utóbbi évtizedekben folyamatosan romló tendenciát mutat. A lokalizált betegség kezelésének alapja a műtét. Az optimális adjuváns és palliatív szisztémás terápiát megalapozó prospektív vizsgálati eredmények híján az SBA gyógyszeres kezelése a colorectalis carcinoma (CRC) kezelési protokollok alkalmazására épült. Azonban a jelenleg folyamatosan bővülő genetikai és molekuláris vizsgálati adatok az egyéb gastrointestinalis daganatoktól eltérő profilra utalnak, és másfajta terápiás megközelítést kívánnak. Jelen közlemény célja áttekintést adni a jelenlegi adjuváns és palliatív kezelési lehetőségekről, a potenciálisan célozható genetikai eltérések, jelátviteli útvonalak legfrissebb kutatási eredményeiről, ezek mentén a legígéretesebb, zajló klinikai vizsgálatokról, amelyek remélhetően alapvetően bővítik az SBA gyógyszeres kezelésének armamentumát.
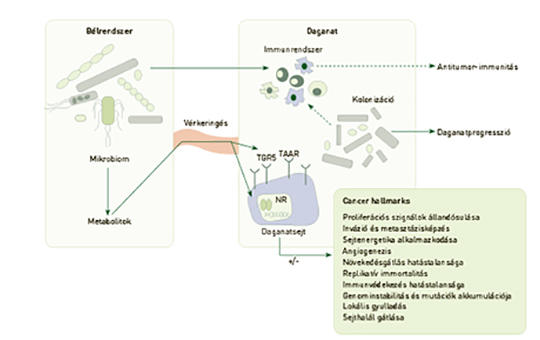
A mikrobiom és a rák
Az emberi szervezet legtöbb szerve és kompartmentje nem steril, ezekben új generációs szekvenálási eljárásokkal bakteriális DNS vagy RNS mutatható ki. Az egy adott kompartmentben kimutatható baktérium örökítőanyag összességét metagenomnak, a transzkriptek összességét metatranszkriptomnak, a baktériumok összességét pedig mikrobiomnak nevezzük. A mikrobiom összetétele megváltozik neoplasztikus betegségekben, amit onkobiózisnak nevezünk, az így kialakult fajösszetételt pedig onkobiomnak. A daganatok jelentős része kolonizálódik, és a daganatokban található baktériumok elősegítik a daganat növekedését, illetve fejlődését. A daganattól távoli kompartmentek (például bél) is áteshetnek onkobiotikus transzformáción. A bélmikrobiom onkobiotikus transzformációja során csökken a bélmikrobiom metabolikus kapacitása és több citosztatikus bakteriális metabolit szintézise lecsökken, ami a daganatsejtek proliferációjához és a metasztázisok képződéséhez vezet. A bélmikrobiom immunológiai tulajdonságai alapvetően meghatározzák azt, hogy az immunrendszer mennyiben tolerogén a daganatsejtekkel szemben, így elsődleges a daganatimmunitás szempontjából. Az onkobiózis önmagában nem indukál daganatokat, azonban elősegítheti növekedésüket és metasztázisképző képességüket. A baktériumoknak fontos szerepe van az antineoplasztikus terápia sikerességében, illetve a mellékhatások kialakításában.
Klinikum
2021. NOVEMBER 04.
Holisztikus betegségkockázat-becslés
Hosszú utat kell még megtennünk ahhoz, hogy a személyre szabott orvoslás ígérete valóra válhasson a rutin egészségügyi ellátásban. Két neves genetikus a Nature-ben ismerteti az individuális betegségkockázat pontos meghatározásához szükséges teendőket.
A pancreascarcinoma preoperatív kezelésének átformálása a precíziós medicina korában
Ez az áttekintés összefoglalja a pancreascarcinoma preoperatív kezelési stratégiáira vonatkozó legújabb bizonyítékokat, és a nem metasztatizáló betegség esetén tárgyalja a személyre szabott terápiás módszer mielőbbi bevezetésének szükségességét és észszerű magyarázatát. A pancreascarcinoma molekuláris diverzitása, és annak a prognózisra és a terápiás válaszra gyakorolt hatása, kombinálva az „összes ígéretes új szerrel” végzett kezelések sikertelenségével, jelentős hatást gyakorol a betegség lefolyására, ami paradigmaváltást tesz szükségessé a genomika által irányított megközelítés felé. Ez különösen fontos a preoperatív, potenciálisan gyógyítható esetekben, ahol a személyre szabott kezelés megválasztásában jelentős potenciál rejlik, ami csökkenti a hasnyálmirigyrák mortalitását.
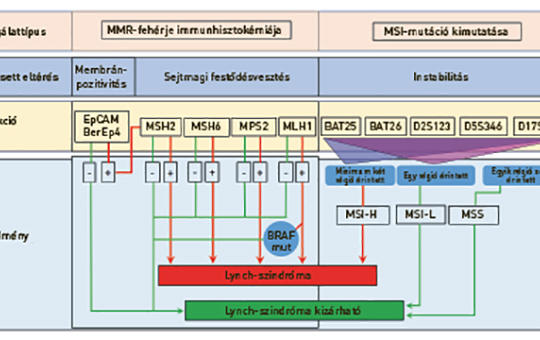
Mikroszatelliták mint a genom „szeizmográfjai”
A genetikai állomány fehérjét nem kódoló, monotonon ismétlődő, 1–6 nukleotidot tartalmazó szakaszain, a mikroszatellitákon a DNS-kettőződésért felelős polimerázok könnyen hibáznak. Így azok rövidülnek vagy hosszabbak lesznek. Ha az ilyen típusú DNS-hibákat javító enzimek működőképesek, a mutációk kijavítódnak. Ha nem, akkor különböző hosszúságú szakaszokként, instabil formában adódnak át az utódsejtekbe. Nemcsak korán jelzik a fokozott mutációs hajlamot, hanem önmagukban is, keretleolvasási problémát okozva, továbbiakat generálnak. Következésképpen a mikroszatellita-instabil (MSI) daganatok nagyobb arányban fejeznek ki idegen antigéneket, mint ezen eltérést nem mutatók, ami a tumorellenes immunválasz fokozott hatékonyságát valószínűsíti. Az MSI tehát nemcsak a genetikai instabilitásra, hanem az immunellenőrzőpont-gátló szerek hatásosságára is utal. Jelenlétét lehet közvetlenül, nukleotidfelbontási szintű PCR-alapú eljárással vagy közvetve, a hibajavító fehérjék kimutatásával, immunhisztokémiával vizsgálni, de ma már új generációs szekvenálási adatokból és mesterséges intelligencia képi elemzésből is kinyerhetők ilyen információk. Az MSI-meghatározás módszertanát és klinikai jelentőségét foglaljuk össze.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.