Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 257
Biomarkerek szerepe a gastrointestinalis daganatok kezelésében
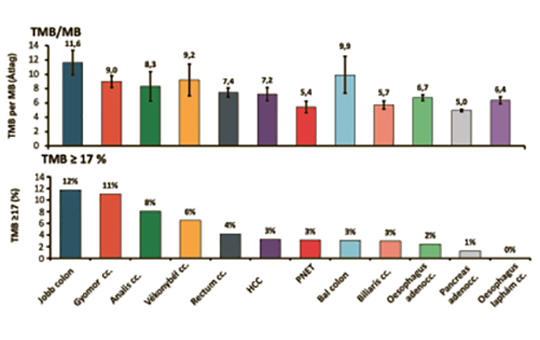
Összefoglaló – A komprehenzív molekuláris profilvizsgálatokon, a bioinformatika fejlődésén alapuló precíziós onkológiai megközelítés, célzott terápia és immunellenőrzőpont-inhibitorok (immune checkpoint inhibitors – ICI) gyökeresen változtatta meg az onkoterápia eredményeit. Az előrehaladott, metasztatikus stádiumú emésztőrendszeri daganatokban szenvedő betegek kedvezőtlen túlélési esélye jelentősen javult az új terápiás lehetőségek alkalmazásától. A sikeres terápia azonban számos molekuláris jellemző ismeretét, meghatározását igényli – PD-L1 expresszió, MSI (mikroszatellita-instabilitás)/dMMR (mismatch repair deficiency), TMB (tumor mutational burden), rezisztenciamutációk, genetikai variánsok jelenléte. Jelen összefoglaló célja áttekintést adni a gastrointestinalis (GI) traktus rosszindulatú daganatainak precíziós onkológiai szemléletű kezelésében alkalmazható prediktív és prognosztikus biomarkerek szerepéről, jelentőségéről.
Újdonságok a nem kissejtes tüdőrák szisztémás kezelésében
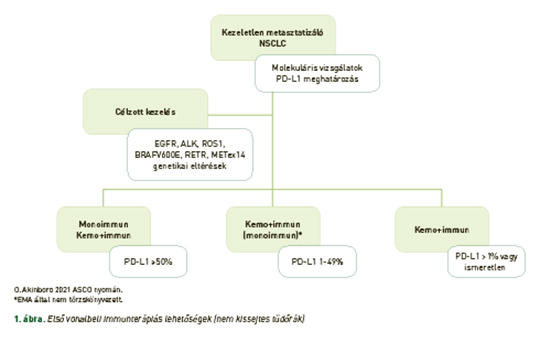
Összefoglaló – Az utóbbi években a nem kissejtes tüdőrák kezelésében forradalmian új előrelépések történtek. Ennek többek között a legfőbb oka, hogy a daganatheterogenitást figyelembe vevő gyógyszeres kezeléseket már széles körben alkalmazhatunk. A célzott kezelések vonatkozásában újabb és újabb olyan génhibákra derül fény, amelyhez hatékony célzott terápia köthető. Az immunellenőrzőpont-gátló kezelések eredményei szintén rendkívül figyelemreméltók mind metasztatizáló, mind lokálisan kiterjedt stádiumban. Mind a célzott kezelések, mind pedig az immunterápia vonatkozásában is igaz, hogy újabb és újabb eredmények látnak napvilágot a korai stádiumú nem kissejtes tüdőrák perioperatív kezelésével kapcsolatban. Ebben a közleményben, a terjedelmi korlátokat is figyelembe véve, a teljesség igénye nélkül ismertetjük a nem kissejtes tüdőrákkal kapcsolatos újabb kezelési eredményeket, bevonva a célzott terápiákat és az immunellenőrzőpont-gátló kezeléseket a komplex daganatellenes terápiába.
Magyarországon minden nyolcadik nőnél diagnosztizálnak emlődaganatot– a digitális egészségügyi fejlesztések új korszakot nyithatnak a mellrák diagnosztikájában és kezelésében
Magyarországon egy a nyolchoz az esélye, hogy egy nőt az élete során mellrákkal diagnosztizáljanak. Nagyon fontos a megelőzés, a kétévenkénti rákszűrés, hiszen az emlőrák a nőknél a leggyakoribb daganat. Magyarországon évente 7500 új esetet diagnosztizálnak, és 2000 nő hal meg mellrákban. Az emlődaganatok kezelésében is egyre nagyobb teret kapnak a személyre szabott, célzott terápiák. Az Oncompass Medicine tudományos igazgatója, dr. Peták István és csapata egy olyan mesterséges intelligencia (MI) alapú eszközt - kalkulátorszoftvert – fejlesztett ki, ami az orvosoknak segít kiválasztani a leghatékonyabb célzott kezelést a beteg számára.
Klinikum
2021. NOVEMBER 04.
Holisztikus betegségkockázat-becslés
Hosszú utat kell még megtennünk ahhoz, hogy a személyre szabott orvoslás ígérete valóra válhasson a rutin egészségügyi ellátásban. Két neves genetikus a Nature-ben ismerteti az individuális betegségkockázat pontos meghatározásához szükséges teendőket.
Epilepsziával járó autoimmun encephalitis miatt kezelt betegek klinikai összegzése epilepsziacentrumban
Az autoimmun encephalitisek a kóros, gyakran epilepsziát okozó immunológiai folyamatok széles körét ölelik föl, melyekben számos esetben kimutathatók neuronalis intracelluláris vagy sejtfelszíni antigének ellen termelődő antitestek. A betegség prevalenciáját napjainkban is alábecsülik, a diagnosztikus lépések és a pontos kezelési metodika nem teljesen tisztázott. Célunk az Országos Klinikai Idegtudományi Intézet Epilepszia Részlegén autoimmun encephalitis miatt gondozott betegek egyes alcsoportjai közötti klinikai, radiológiai, pszichopatológiai és elektrofiziológiai különbségek összegzése. Összesen 40 beteget választottunk be vizsgálatunkba; a betegeket a detektált antitestek, a klinikai, radiológiai, elektrofiziológiai szempontok alapján 9 különböző csoportba soroltuk. A legtöbb (n=11) beteg esetében GAD elleni antitestet találtunk, GABA-B receptor elleni antitest a legkevesebb, 1 beteg esetében volt. A legalacsonyabb átlagéletkorral (16,7 év) a posztinfekciós encephalitisszel (FIRES) diagnosztizált betegek, a legmagasabbal (50,4 év) a paraneoplasiás antitesteket termelő betegek rendelkeztek. A társbetegségeket megfigyelve az anti-GAD antitesttel rendelkezők több mint felének autoimmun pajzsmirigybetegsége volt. A vizsgált vasculitisszel diagnosztizált, anti-GABA-B antitesttel rendelkező és Rasmussen-kórban szenvedő betegeknél a koponya-MRI-vizsgálaton a betegségükkel összefüggő eltérés látszott, míg akiknél paraneoplasiás vagy anti-NMDA antitestet detektáltunk, a betegséggel összefüggésben lévő MRI-eltérés nem igazolódott. Az egy csoportba sorolt betegek antiepileptikus, illetve immunszuppresszáns kezelésre adott válasza is hasonló volt. A felszíni antigének ellen termelődött antitesttel bíró betegek esetén jobb volt a terápiás válasz, a leginkább terápiarefrakter betegek a Rasmussen- és a FIRES-csoportba tartoztak. Az autoimmun encephalitis egyes alcsoportjainak fenotípusa hasonló, de a klinikai megnyilvánulás, az EEGés az MR-vizsgálatok átfogó értékelése segíthet egy jól meghatározott rendellenesség diagnosztizálásában. Néhány példát említve, a pajzsimigybetegséggel társuló, MRI-negatív epilepszia hátterében anti-GAD-pozitív encephalitis is állhat. Memóriazavarral, TGA-val járó rosszullétek esetén későbbi életkorban paraneoplasiás mechanizmust is feltételezhetünk, ez segíthet malignus folyamat felfedezésében. Az autoimmun encephalitisben szenvedő betegekre csoportspecifikusan más-más klinikai minták igazak, és egy-egy csoportra különböző terápiás szükséglet, illetve különböző terápiás válasz jellemző. A jövő kihívása többek között a betegség korai felismerése, az encephalitis hátterében álló immunpatológiai folyamatok pontosabb megértése, és a megfelelő időben történő célzott kezelés kidolgozása, melyhez további vizsgálatok szükségesek.
Neuroborreliosis által okozott kisérvasculitis diagnózisa és komplex kezelése
Bevezetés: A neuroborreliosis a Lyme-kór korai vagy késői szövődménye, ami a fertőzöttek 10-15%-ában alakul ki a B. burgdorferi hematogén vagy közvetlenül a perifériás, illetve agyidegek mentén történő terjedése révén. A korai stádiumban lymphocytás meningitis, agyidegtünetek, polyradiculopathia, a késői stádiumban myelitis, ritkán encephalitis jelentkezhet. Központi idegrendszeri vasculitis a fertőzöttek 0,3–1%-ában alakul ki, jellemzően a vertebrobasilaris rendszerben. Főként a nagy, de ritkán a kisereket is érinti. Szekunder profilaxisként célzott antibiotikum-terápia alkalmazandó, ezért fontos a fertőzés kimutatása. Módszer: Egy 52 éves férfi beteg esetét mutatjuk be, aki hirtelen kialakult dysarthria, poliglott aphasia, járási és törzsataxia miatt jelentkezett kivizsgálásra. A koponya- MR-vizsgálat által igazolt multiplex ischaemiás laesiók lokalizációja, valamint az emelkedett liquorösszfehérje alapján felmerült kisérvasculitis lehetősége. A beteg állapota egy héten belül romlott, a kontroll-MR-vizsgálat a laesiók számának jelentős növekedését igazolta. HIV, HBV, HCV, HSV1, VZV, Borrelia, lues szűrővizsgálatokat végeztünk, illetve szisztémás autoimmun betegségekben megjelenő autoantitesteket vizsgáltunk (ANA, ANCA, anti-SSA, anti-SSB, anti-DNS, anti-Scl-70, anti- Jo-1, anti-Sm, anti-beta-2-glikoprotein, anti-cardiolipin). B. burgdorferi elleni antitest jelenlétét igazoltunk a szérumban és a liquorban. A liquor-/szérumantitest arány intrathecalis antitestképzést bizonyított. (A többi vizsgálat negatív eredménnyel zárult.) A beteget a terápiás protokollnak megfelelően iv. ceftriaxonnal kezeltük. A beteg állapota a kezelés után tovább romlott, az ismételten elvégzett kontroll-koponya-MR a laesiók számának és méretének progresszióját igazolta. Ekkor immunológus bevonásával per os szteroid- és azathioprinkezelést kezdtünk. A kontroll-MR-vizsgálatok további progressziót igazoltak, ezért rituximabra váltottunk, mely mellett a beteg állapota klinikailag javult, a képalkotó vizsgálatok újabb laesiókat nem mutattak ki. Eredmények: A fenti vizsgálatok alapján neuroborreliosissal összefüggésbe hozható kisérvasculitist állapítottunk meg. Következtetés: Tekintettel arra, hogy a betegség a célzott antibiotikum-kezelést követően is progrediált, felvetjük parainfekciózus immunmediált patomechanizmus lehetőségét.
Az új generációs szekvenálás szerepe a klinikai onkológiában
Az új generációs szekvenálás megjelenése az elmúlt évtizedben az onkológiai entitások molekuláris hátterének részletes megismeréséhez vezetett. A technológiai fejlődéssel párhuzamosan új célzott terápiás lehetőségek váltak elérhetővé az onkológiai betegek számára. A folyamat eredményeképpen a molekuláris diagnosztikai vizsgálatok, a prediktív biomarkerek vizsgálatának köszönhetően, mára a precíziós medicina alappillérévé váltak. A klasszikus monogénes vizsgálatok mellett az elmúlt években előtérbe kerültek a célzott terápiatervezést támogató, új generációs szekvenáláson alapuló multigénes genetikai vizsgálatok. Közleményünkben a multigénes új generációs szekvenálás alkalmazása és az eredmények interpretációja kapcsán felmerülő legfontosabb szakmai szempontokat tekintjük át.
A daganatos elváltozások hatékony diagnosztikáját segítő labort alakítottak ki Szegeden
A daganatos elváltozások hatékony diagnosztikáját segítő laboratóriumot alakítottak ki uniós támogatással a Szegedi Tudományegyetem (SZTE) patológiai intézetében – tájékoztatta a felsőoktatási intézmény közkapcsolati igazgatósága az MTI-t.
Neurológiai tünetek és emelkedett kórházi mortalitás Covid-19-ben
Mint azt az elmúlt egy év tapasztalatai mutatják, a Covid a tüdőn túl számos egyéb szerv működésében képes kárt okozni. A vese-, máj-, szívérintettségen túl gyakran észlelhetünk az idegrendszert érintő manifesztációt is: többek között fejfájás, anosmia, új stroke vagy a már elszenvedett stroke tüneteinek felerősödése, epilepsziás betegekben emelkedett rohamfrekvencia, Guillain–Barré-szindróma, meningoencephalitis, akut demyelinisatiós encephalomyelitis (ADEM) társulhat a koronavírus-fertőzéshez. Eskandar és társai a Neurology-ban megjelent cikkükben azt vizsgálták, hogy a kórházi ellátást igénylő covidos esetekben a neurológiai tünetek megjelenése együtt jár-e a betegek halálozásának fokozott kockázatával.
Jövő Unikornisa Díj a rákdiagnosztikát segítő fejlesztésért
A Digital Europe kereskedelmi szövetség ebben az évben a Peták István és Schwab Richárd kutatóorvosok által alapított Oncompass Medicine molekuláris diagnosztikával és precíziós orvoslással foglalkozó céget díjazta a Jövő Unikornisa Díjával. A kitüntetést azon technológiai vállalkozásoknak adományozzák, amelyek jövőbeli értéke meghaladhatja az egymilliárd dollárt. Az Oncompass Medicine-t 17 európai ország legkülönfélébb területeken működő vállalkozásai közül választották ki. Az elismerést Mariya Gabriel az EU innovációért felelős biztosa adta át virtuálisan a magyar biotechnológiai cégnek 2021. február 4-én, a rák világnapján. A Jövő Unikornisa Díjat a kutatóorvosok a daganatos betegek célzott terápiájának segítésére fejlesztett orvosi szoftverrel érdemelték ki. A Real-Time Oncology Treatment Calculator (TM) elnevezésű informatikai eszköz példátlanul sok, 405 ráktípusban, 52 ezer mutáció esetén, 26 838 orvosbiológiai szabály alapján, 1417 gyógyszerhatóanyag közül képes rangsorolni az adott beteg betegségéhez és genetikai profiljához kijelölhető, legjobb reményekkel kecsegtető terápiákat. Mindehhez pedig 0,02 másodpercre van szüksége. Peták István évtizedek óta foglalkozik molekuláris rákdiagnosztikával, személyre szabott precíziós onkológiával, célzott gyógyszerfejlesztéssel. A kutató a díj alkalmából adott interjút folyóiratunknak.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.