Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 93
Hogyan befolyásolja a BRCA-státusz az emlőrák ellátását 2019-ben?
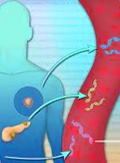
A germinalis BRCA-státusz korai vagy előrehaladott/áttétes emlőrákban egyaránt befolyásolja az ellátás menetét. Így ideális esetben a beteg informáltan dönthet a műtét típusáról, a sugárkezelés elkerüléséről; a BRCA-státusz a legújabb eredmények alapján befolyásolja a neoadjuváns, adjuváns, palliatív kemoterápia megválasztását, továbbá új, hatékony célzott (target) terápia alkalmazását vetheti fel. Specifikus terápiának számítanak a DNS-támadáspontú citosztatikumok, mindenekelőtt a platinakészítmények és a szintetikus letalitás elve alapján ható PARP-inhibitorok. E speciális gyógyszercsoportok optimális helye és sorrendje egyelőre nem ismert. A nemzetközi ajánlások valamennyi HER2-negatív (NCCN) vagy legalább a mutatók alapján valószínű BRCA-mutációt hordozó (ESMO) előrehaladott/áttétes emlőrákos esetben sürgetik a BRCA-státusz-vizsgálatot a megfelelő terápiás stratégia meghatározása érdekében. Az elmúlt időszakban a BRCA-státusz meghatározására szolgáló módszerek óriási fejlődésen mentek át, és egyre szélesebb körben elérhetőek különféle szolgáltatók kínálatában. A mutáció azonosításához a teljes gének szekvenálása szükséges, amelyre a korábbi módszereknél gyorsabb és költséghatékonyabb megoldást nyújt az új generációs szekvenálóplatformok (next generation sequencing - NGS) alkalmazása. A kezelőorvos felelőssége, hogy amennyiben a részletes családi anamnézis, a beteg életkora, esetleges megelőző daganatos betegsége és nem utolsósorban a daganatjellemzők alapján felmerül, gondoljon patogén BRCA-mutáció jelenlétére, mérlegelje a teszt indokoltságát, illetve vesse fel a beteg számára a lehetőséget.
Folyékony biopszia a klinikai onkológiában – a precíziós orvoslás vonalvezetője
A tumorok genetikai jellemzésének klasszikus módja a szöveti biopszia, amelynek során kis mennyiségű minta kerül kivételre az érintett szervből. Ez képviseli a tumort a további vizsgálatok során. A mintavétel lokalizáltsága azonban korlátozza a reprezentatív jellemzést. Egyszerű mintavétellel a vérplazmából izolált, úgynevezett keringő tumor-DNS potenciálisan minden, markerként azonosítható genetikai eltérést hordozó daganatszövet onkológiai vizsgálatára alkalmas lehet. Ahhoz, hogy a benne rejlő lehetőségeket minél hatékonyabban kiaknázhassuk, sajátos tulajdonságaihoz kell igazítani a vizsgálati eszközöket. A minta pre analitikai feldolgozása és tárolása jelentősen befolyásolja a további felhasználhatóságot. Ahhoz, hogy a jelentős többségben lévő vad típusú háttér mellett az esetlegesen jelen lévő mutáció kimutatható legyen, új, specifikus módszerek kidolgozására van szükség, amelyek jelentős többsége az új generációs DNS-szekvenálási technikákra épül. Az elmúlt évtizedben ezen eljárások költségének határozott csökkenése lehetővé tette, hogy óriási mennyiségű genetikai információ halmozódjon fel a tumorigenezissel kapcsolatban. A szekvenálási technológiák fejlődése következtében a vizsgálatok átfutási ideje is csökkent, így lehetővé vált a kutatás mellett a rutinellátásba való átvétele. Kutatásainkból kiindulóan ez három megközelítésen keresztül valósulhat meg: technológiai fejlesztéssel, a már birtokunkban lévő diagnosztikai módszerek folyékony biopsziába való átültetésével, valamint jól tervezett, betegségspecifikus génpanelek létrehozásával. A nemzetközi trendek és eddigi, folyékony biopszián alapuló tapasztalataink alapján is úgy gondoljuk, hogy a közeljövőben ez a módszer az onkológiai szűrések és a precíziós onkológia egyik meghatározó pillérévé válhat.
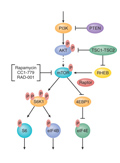
PI3K–AKT–mTOR-jelút gátlása mint terápiás célpont
A PI3K-AKT-mTOR az egyik legforgalmasabb út a sejtjeinkben, jelek fogadásával és továbbadásával, átkapcsolásaival (RAS-út, ligandok), beépített gátlóival (PTEN) a sejtműködés szabályozásának kulcseleme. Ehhez a sejttípusonként eltérő bonyolult rendszerhez megfelelően komplex szabályozás társul. A szabályozásban szereplők hibái (mutáció, amplifikáció, deléció) daganatok kialakulásához vezethetnek, egyben a tumorellenes terápiák fontos célpontjai lehetnek. Engedélyt klinikai alkalmazásra eddig csak négy szer kapott. Ennek a csalódást okozó eredménynek a hátterében számos probléma húzódhat meg. Ilyen a biomarker hiánya, ami a betegek kiválasztását tehetné hatékonyabbá, a grade 3-4 toxicitási mellékhatások magas aránya, a terápiás szer pontatlansága, de az is felvethető, hogy a támadott célpontok nem a daganat meghatározó mozgatói, nem driverhibák. Az a tanulság biztosan levonható, hogy értékelhető klinikai válasz csak kombinált kezeléstől várható.
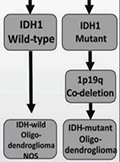
[Az izocitrát-dehidrogenáz-mutációk szerepe a glioblastoma biológiájában és a terápiás döntéshozatalban]
[Az onkogenezis sorozatos szomatikus mutációk felhalmozódásához köthető. Számos daganat esetében megtörtént a genomikai háttér átfogó elemzése, és a glioblastoma az elsők között volt.]
Fúziók szolid tumorokban
A genetikai fúziók a genomikai átrendeződés következtében alakulnak ki. Ide tartozik a kromoszomális inverzió, az interstitialis deletio, az amplifikáció vagy a transzlokáció. Mindezek képesek befolyásolni a daganatok keletkezését és progresszióját. A fúziókat először hematológiai tumorokon mutatták ki (például BCR-ABL), de megjelentek szolid tumorokban is, a technikák függvényében. Nagy érzékenységű szekvenátorral nyert adatokból kiderült, hogy fúziók ritkán fordulnak elő, ezen belül is kevés az onkogénként viselkedők aránya, a többi passenger, ami magyarázza a fals pozitív esetek nagy számát. Néhány fúzió, mint driver mutáció, terápiás célpontként való alkalmazását (ALK, ROS1, PDGFB) engedélyezte az FDA. Mint más célpontok kezelésénél, rezisztencia alakulhat ki, amelyet második és harmadik generációs szerekkel próbálnak meg kivédeni.
A tüdőrák immunterápiája az újabb eredmények tükrében
Tíz évvel ezelőtt az előrehaladott stádiumú tüdőrák esetén, mind a kissejtes (SCLC), mind pedig a nem kissejtes (NSCLC) csoportban, a várható átlagos túlélés egy év körüli volt. Ez, sajnos, az SCLC esetén lényegileg mára sem változott. Az NSCLC kezelésében igazi forradalmi időszakot élünk át. A patológiai alcsoportokra specifikált kombinált citotoxikus kemoterápia mellett igen hosszú túléléssel kecsegtet a célzott terápia (EGFR-mutáció, ALK, ROS1, BRAF-pozitivitás esetén). Az SCLC vonatkozásában a klinikai gyakorlat tekintetében jelentős előrelépés a gyógyszeres kezelésben az utóbbi harminc évben nem történt. Az újabb terápiás lehetőség NSCLC fennállásakor előrehaladott stádiumban az immunellenőrzőpont-gátló terápia, amely három éve már a klinikumban is a komplex kezelés része, hazánkban is. A PD1, a PDL1 és a CTLA4-gátló vegyületek beépítése a terápiás gyakorlatba igazi, új kihívás. Előrehaladott stádiumú NSCLC fennállásakor, magas PDL1-expresszió esetén, első vonalban új standard a pembrolizumab-monoterápia. Második vonalban mind a pembrolizumab, mind a nivolumab, mind pedig az atezolizumab evidenciaalapon adható. Az NSCLC-betegek mintegy harmadát kitevő lokálisan kiterjedt esetekben a radiokemoterápia után alkalmazott konszolidációs fenntartó durvalumab terápia új hatékony lehetőség. Az eddigi gyógyszeres terápiás nihilizmus az SCLC esetén oldódni látszik. Az antitestgyógyszerkonjugátummal végzett terápia alkalmazásának lehetősége már a közeljövőben a klinikumban is várható. A nivolumab, illetőleg a nivolumab + ipilimumab kombináció szintén ígéretes eredményekkel kecsegtet SCLC másod-, illetőleg többedvonalbeli kezeléseként. A biomarker-szelekción alapuló kezelési terv mind NSCLC, mind pedig SCLC esetén részben gyakorlat, részben kutatási irány (például PDL1-expresszió, szomatikus mutációs arány [TMB], DLL3, cMyc stb.). A különböző gyógyszeres kezelési modalitások egyedi alkalmazása helyett az okos, biomarker-szelekción alapuló komplex terápiás stratégia segíthet e betegség eddigi szerény terápiás eredményeinek javításában, krónikus betegséggé való formálásában.
Amikor az orvos egyben filozófus is volt
Habár a filozófusok, a bölcsesség szeretői minden korban kevesen vannak, a filozófiának léteznek sűrűsödési időszakai. Ilyen koncentrált periódus volt az ókori görög (athéni) civilizáció aranykora. A medicina értékrendjét, metafizikáját (az aktív eutanázia és a magzatelhajtás tilalmát, „a beteg java a legfőbb törvény” -t) az aszklépioszi hagyomány alapján kinyilatkoztató, s az empirikusan vizsgálható fizikai hatóokról szóló kórtani elméletét (humorálpatológia) úgyszintén megteremtő Hippokratész kilenc évvel volt fiatalabb Szókratésznél, s amikor meghalt, Platón már az ötvenedik életévébe lépett.
MEK és ERK - RAS és RAF ellen
A célzott terápia kezdeti klinikai hatása után a legtöbb esetben a tumor rezisztenssé válik a kezeléssel szemben, aminek megfordítása jelenleg az egyik legnagyobb probléma a klinikai onkológiai gyakorlatban. Ennek a szekunder rezisztenciának sok oka lehet, pl. új driver mutáció jelenik meg a kezelt tumorban, az eredeti célponttól eltérő hibát tartalmazó klón lesz a meghatározó, a tumorsejtek funkcióinak, elsősorban proliferációjának szabályozását egy másik jelút veszi át. (Az sem közömbös, hogy a célzott terápiára lokálisan előrehaladt és/vagy metasztatikus tumorok esetében kerül sor.) Ilyen változások igen gyakoriak a RAS-RAF-MEK-ERK jelátviteli úton. A zavarokat főleg mutációk okozzák, és vezetnek a tumorsejtek korlátlan szaporodásához, terjedéséhez. Az egyik kulcsproblémát a RAS mutációi jelentik, amelyek befolyásolása ma még megoldatlan. A leggyakoribb BRAF leggyakoribb mutációját gátlószerekkel sikerült átmeneti klinikai választ elérni, főleg melanomákon. Felmerült, hogy a kóros jelátvitel megakadályozását a jelúton a MEK és/vagy ERK gátlásával lehetne elérni, hiszen ezek aktivitása a fenti hibák miatt fokozottá válik. Ezek a próbálkozások a logikus elgondolás ellenére áttörő sikert még nem értek el. Ez az összefoglaló elsősorban a MEK-kel kapcsolatos eredményeket, a további lehetőségeket tekinti át.
A random variancia mint karcinogén tényező?
Egyes ráktípusoknál egy eddig nem tárgyalt, független tényező is hozzájárulhat a rák megjelenéséhez — mégpedig a DNS osztódása során megjelenő véletlenszerű hibák okozta mutációk, a random variancia hatása.
Hírvilág
2017. ÁPRILIS 04.
Információval a rákbetegek hatékonyabb gyógyításáért
Az OncompassMedicine egy viszonylag új szervezet, amely a KPS Molekuláris Diagnosztikai Központba utóda, s amelyet két hazai kutatóorvos, dr. Peták István és dr. Schwab Richárd hozott létre több mint 10 éve.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.