Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 93
Jövő Unikornisa Díj a rákdiagnosztikát segítő fejlesztésért
A Digital Europe kereskedelmi szövetség ebben az évben a Peták István és Schwab Richárd kutatóorvosok által alapított Oncompass Medicine molekuláris diagnosztikával és precíziós orvoslással foglalkozó céget díjazta a Jövő Unikornisa Díjával. A kitüntetést azon technológiai vállalkozásoknak adományozzák, amelyek jövőbeli értéke meghaladhatja az egymilliárd dollárt. Az Oncompass Medicine-t 17 európai ország legkülönfélébb területeken működő vállalkozásai közül választották ki. Az elismerést Mariya Gabriel az EU innovációért felelős biztosa adta át virtuálisan a magyar biotechnológiai cégnek 2021. február 4-én, a rák világnapján. A Jövő Unikornisa Díjat a kutatóorvosok a daganatos betegek célzott terápiájának segítésére fejlesztett orvosi szoftverrel érdemelték ki. A Real-Time Oncology Treatment Calculator (TM) elnevezésű informatikai eszköz példátlanul sok, 405 ráktípusban, 52 ezer mutáció esetén, 26 838 orvosbiológiai szabály alapján, 1417 gyógyszerhatóanyag közül képes rangsorolni az adott beteg betegségéhez és genetikai profiljához kijelölhető, legjobb reményekkel kecsegtető terápiákat. Mindehhez pedig 0,02 másodpercre van szüksége. Peták István évtizedek óta foglalkozik molekuláris rákdiagnosztikával, személyre szabott precíziós onkológiával, célzott gyógyszerfejlesztéssel. A kutató a díj alkalmából adott interjút folyóiratunknak.
[Új patogén mutáció következtében kialakuló karnitin-palmitoil-transzferáz II-hiánnyal magyarázható ismétlődő rhabdomyolysis]
[A karnitin-palmitoil-transzferáz II- (CPT II-) hiány egy autoszomálisan öröklődő anyagcsere-rendellenesség, amelyben a hosszú láncú zsírsavak β-oxidációja hiányos. A klinikai megjelenés különféle formában lehetséges; súlyos formájában jelentkezik újszülöttkorban és infantilis időszakban, míg iskolás- és serdülőkorban a kevésbé súlyos myopathiás formában jelentkezik. Bár a rhabdomyolysisrohamok súlyossága változó, a klinikai lefolyást esetenként akut veseelégtelenség komplikálhatja. Az acilkarnitin-elemzés segíthet a CPT II diagnosztizálásában, de az eredmény normalitása nem jelzi a betegség hiányát. Erős gyanú esetén genetikai elemzést kell végezni. Ebben a tanulmányban egy 15 éves fiú beteg esetét mutatjuk be, akinek két, fertőzés, illetve éhezés által kiváltott rhabdomyolysisrohama volt. Az acilkarnitin-elemzés eredménye normális volt, a kórtörténet értékelésénél figyelembe vettük a CPT II-hiányt, és kimutattuk a CPT II gén c.137A> G (p.Gln46Arg) új patogén homozigóta mutációját. A CPT II-hiány a metabolikus rhabdomyolysis egyik leggyakoribb oka az ismétlődő rhabdomyolysisepizódoktól szenvedő betegek esetén.]
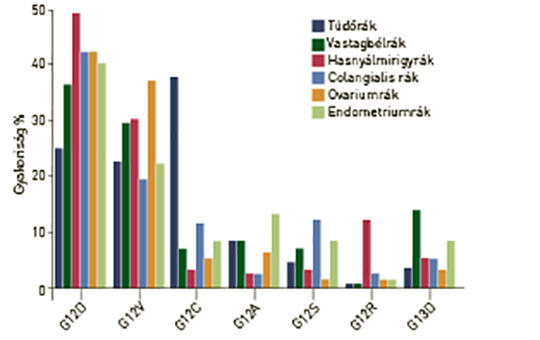
A (K)RAS-mutáció molekuláris epidemiológiája emberi daganatokban
A RAS onkogén mutációja a leggyakoribb génhiba emberi daganatokban, és a három családtag közül a K-RAS-é a leggyakoribb, amit az N-RAS követ. A tipikus K-RAS-mutáns daganatok a hasnyálmirigyrák, vastagbélrák és tüdő-adenocarcinoma, amelyekben a mutáns variáns allélok gyakorisága igen heterogén, aminek hátterében eltérő karcinogenezis áll. A RAS-mutáns daganatok genetikai sokszínűségét tovább fokozza, hogy a mutáns allél homo- vagy heterozigóta formában van-e jelen. A sokszínűség egy másik forrása az, hogy a különféle daganatokban a K-RAS-mutánsok esetében sajátos kísérő mutációs mintázatú altípusok lehetnek. Mindezeknek az a következménye, hogy a K-RAS-mutáns daganatok biológiai viselkedése és nagy valószínűséggel terápiás érzékenysége is nagyon heterogén lehet. A K-RAS-inhibitorok klinikai debütálásával ezeknek a kérdéseknek egyre nagyobb jelentősége lesz.
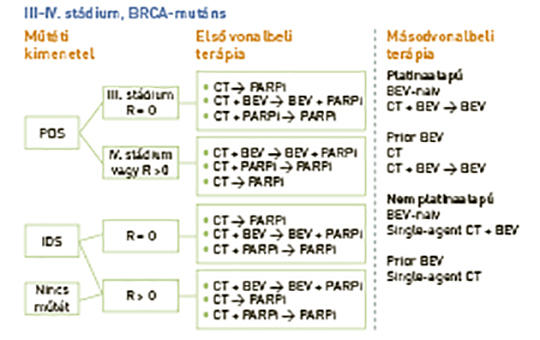
A petefészekrák kezelésének frontvonalában: a PARP-gátlók szerepének megújítása
Kiújult petefészekrákban a poli(ADP-ribóz)polimeráz- (PARP-) gátlókkal történő kezelések megváltoztatták a platinaérzékeny daganatok kezelését. Az új adatok szerint a PARP-gátlókat a kezelési algoritmus korábbi szakaszában kell alkalmazni. A kutatók számba veszik azokat a fázis III vizsgálatokat, amelyekben a PARP-gátlók hatását értékelték újonnan diagnosztizált petefészekrákok primer, illetve fenntartó kezelésében. Megvitatják a gyógyszerek hatásosságát és biztonságosságát az összes daganat, illetve a biomarkerek szerint válogatott daganatok klinikai vizsgálataiban, és összevetik a különböző vizsgálatok előnyeit és korlátait. Fontolóra veszik a jövő kutatásainak prioritásait – különös tekintettel a betegek kiválasztására és a jövőben alkalmazandó, egyelőre hiányzó gyógyszeres regimenek megalkotására. Négy fázis III vizsgálatban (SOLO-1, PAOLA-1/ENGOT-OV25, PRIMA/ENGOT-OV26 és VELIA/GOG-3005) PARP-gátlók használatával (olaparib, niraparib vagy veliparib) a progressziómentes túlélés jelentős javulását figyelték meg petefészekrákos betegekben. A vizsgálatok eltérő kialakítása (kezelés vagy fenntartó kezelés, egy gyógyszeres vagy kombinációs kezelés, bevacizumabbal vagy bevacizumab nélkül), a betegek kiválasztása (műtéti eredmény, biomarkerek elérhetősége, prognózis szerint), a résztvevők eredeti megválasztása (intention-to-treat, BRCA-mutációs vagy homológ rekombinációdeficites pozitív) befolyásolták a vizsgálatokból levonható következtetéseket. A teljes túlélési adatok még függőben vannak, hosszú távú biztonságossági adatok is csak korlátozottan állnak rendelkezésre. A PARP-gátlók sarkalatos szerepet játszanak az újonnan kimutatott petefészekrák-ellátásban, és befolyásolják a további kezeléseket. Ki kell választani azokat a betegeket és gyógyszereket, akiknél az eddigi alkalmazott kezelések a PARP-gátlóknál kevesebb haszonnal járnának.
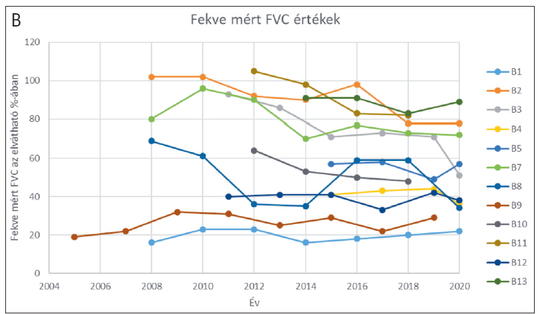
A késői kezdetű Pompe-kórban szenvedők enzimpótló kezelésének hosszú távú követése
A Pompe-kór (PD) egy ritka lizoszomális tárolási betegség, amit a GAA gén mutációja következtében kialakuló α-glükozidáz (GAA) enzim elégtelen működése okoz. Az enzimdeficientia a glikogén lizoszomális felszaporodásához vezet. A betegségnek két klinikai formája ismert, az újszülöttkori, valamint a késői forma. Jelenleg a betegség hátterében a GAA génnek közel 600 mutációja ismert. A kaukázusi populációban a késői forma hátterében a c.-32-13T>G mutáció a leggyakoribb, az allélfrekvencia közel 70%. A Pompe-kórt enzimpótló terápiával (ERT) tudjuk kezelni, kéthetente Myozyme infúzió adásával. Közleményünkben 13, több mint öt éve kezelt, késői kezdetű formában szenvedő beteg hosszú távú követését mutatjuk be. A leghosszabb követési idő 15 év volt. A kezelés eredményességének megítélésére évente mértük a 6 perces járótávolságot és a légzésfunkciót. Az adatok alapján a 6 perces járótávolság az enzimpótló kezelés indítása után körülbelül 3-4 évig javult, ezt követően az esetek többségében a megtett távolság csökkent. A több mint 10 éves követés után a kezdeti 6 perces járótávolsághoz képest romlást tapasztaltunk az esetek 77%-ában, javulást az esetek 23%-ában. A követés ideje alatt mindössze egyetlen beteg került kerekesszékbe. A légzésfunkció, különösen fekvő helyzetben hasonlóan alakult. A betegek terápiára adott válaszában nagy variabilitást figyeltünk meg, ami csak részben mutatott összefüggést a terápiás fehérje ellen termelődő antitestszinttel. Az ERT eredményessége jelentősen függött a betegséget okozó mutáció típusától, a betegség státuszától a kezelés kezdetekor, a beteg fizikai aktivitásától és táplálkozási szokásaitól. Az innovatív orphan gyógyszerekkel kezelt betegek hosszú távú követése kiemelkedően fontos ahhoz, hogy megismerjük a kezelés valós hasznát és a betegek igényeit.
Daganattúlélők nőihormon-pótló kezelése – Irodalmi áttekintés
Az onkológia gyors fejlődése az onkológiai betegek mind hosszabb túléléséhez vezet. Közülük egyre többen érik el a természetes menopauzát, vagy onkoterápiájuk mellékhatásaként idő előtt tapasztalják a gonadalis funkciók megszűnését, vazomotoros tünetekkel és hosszú távú negatív cardiovascularis és csontrendszerre gyakorolt hatásokkal. Egyre növekvő számban kérnek ilyen betegek endokrinológiai segítséget hormonpótló terápia (HRT) formájában. A WHI (Women’s Health Initiative) tanulmány eredményeinek téves értelmezése irracionális félelemhez vezetett a nőihormon-pótlás tekintetében mind a betegek, mind az orvosok körében. Számos orvos számára logikus és biztonságos következtetésnek tűnik a HRT elkerülése, feltételezve, hogy ez a hozzáállás biztosan nem okoz kárt, míg az ösztrogén önmagában vagy gesztagénekkel történő alkalmazása onkológiai és thrombemboliás kockázatokat hordoz, szövődmények esetén pedig peres eljárásokhoz is vezethet. Ugyanakkor már a WHI-tanulmány eredményei előtt is ismert volt, hogy a korai menopauza és hypogonadismus a skeletalis és a cardiovascularis hatások révén évekkel csökkenti a nők várható élettartamát, és ez a negatív hatás korrelál a hypoestrogenaemiás időszak hosszával. HRT-ről való döntés esetén ezeket a pró és kontra érveket kell mérlegelni úgy, hogy a HRT onkológiai kockázatát rendkívül nehéz objektíven felbecsülni. Összefoglaló tanulmányunkban áttekintjük a témával kapcsolatos legfrissebb evidenciákat az in vitro kísérletektől a klinikai vizsgálatokig, mind nőgyógyászati, mind nem nőgyógyászati daganatok túlélőinek vonatkozásában. Ez alapján a következő csoportokat határoztuk meg: a „HRT előnyös” (például I-es típusú endometriumcarcinoma, méhnyak-adenocarcinoma, malignus hematológiai betegségek, lokális melanoma malignum, colorectalis carcinoma, hepatocellularis carcinoma); a „HRT neutrális” (például BRCA 1/2 mutációt hordozóknál tumoros megbetegedés nélkül, II-es típusú endometriumcarcinoma, méhcarcinosarcoma és adenosarcoma, egyes ovariumtumorok, méhnyak-, hüvelyi és vulvalaphámrák, prolactinoma, veserák, hasnyálmirigyrák, pajzsmirigyrák); a „HRT relatíve ellenjavallt” különféle okok miatt (például leiomyosarcoma, bizonyos petefészekrákok, agydaganatok, előrehaladott metasztatikus malignus melanoma, tüdőrák, gyomorrák, húgyhólyagrák esetén); a „HRT kedvezőtlen hatású, ezért ellenjavallt” (például emlőrák, endometrium-, stromasarcoma, meningioma, glioma, hormonreceptor-pozitív gyomor- és hólyagrák).
Petefészekrákban szenvedő betegek nem sebészi kezelése
A petefészekrákban szenvedő betegek kezelésében alapvető a kellően radikális műtét, amely az egyéb módszerek eredményességét is meghatározza. Az ezt követően, egy ülésben végzett hyperthermiás intraperitonealis kemoterápia 40,5–42,5 Celsius-fokos citosztatikus oldat perfúziójával történik. A szisztémás kezelések megválasztásában a hat hónapos progressziómentesség a mérföldkő, ezentúl platinaszenzitív, ezen belül -refrakter vagy -rezisztens betegségről van szó. A citosztatikus kezelés fejlődése az alkilálószerektől a platinaszármazékokon át a paklitaxel alkalmazásáig terjed, különféle kombinációkkal, egyre jobb eredményekkel és mind kevesebb mellékhatással. A célzott terápiában az érújdonképződés-gátlók (főleg a bevacizumab) és a DNS-hibák javítását megakadályozó, PARP-gátlók a legjelentősebbek; ez utóbbiak esetében általában a platinaérzékenység feltétel, míg a BRCA-mutáció már nem mindig követelmény. Az utóbbi időben az immunterápiával kapcsolatban is ígéretes vizsgálatok folynak. A hormonkezelés fő előnye a jó tolerálhatóság. A gyógyszerek alkalmazásának sikerei mellett visszaszorulni látszik a sugárterápia, pedig a teljes peritonealis felszín ellátása – különösen a korszerű besugárzási technikák alkalmazása mellett – a kemoterápia alternatívája lehet, a palliatív irradiáció pedig a tünetek csökkentése mellett a gyógyszermentes időszakot is megnyújthatja, s a kombinálás lehetőségei további távlatokat nyitnak meg.
Hírvilág
2019. MÁJUS 08.
A tibeti magaslatokon is élt a gyenyiszovai ember
Először azonosítottak gyenyiszovai emberhez köthető fosszíliát a barlangon kívüli területen: egy alsóállkapocs-csontot találtak a Baisija karsztbarlangban, a Tibeti-fennsíkon, 3280 méteres magasságban. A Hsziahónak nevezett csonton uránium-tóriumos kormeghatározást végeztek, melynek eredménye szerint 160 ezer éves lehet.
Aktualitások a férfi emlőrákról
A férfi emlődaganatok ritka betegségek, körülbelül az összes emlődaganat 1%-át teszik ki. A férfi emlődaganatok legnagyobb rizikófaktora a szervezetben előforduló emelkedett ösztrogénszint. Genetikai eltérések, mint a Klinefelter-szindróma, ösztrogénexpozíció és egyéb metabolikus deviancia elősegíthetik a férfi ak emlődaganatának kialakulását. A klinikai tünetek megjelenése és a diagnózis felállítása között hosszabb idő telik el, mint a nőknél, és a férfi emlődaganatokat idősebb korban, előrehaladott stádiumban ismerik fel. A BRCA2-mutáció körülbelül 10%-ban mutatható ki a férfi emlődaganatos betegekben. Leggyakoribb az invazív ductalis carcinoma ösztrogén- és progeszteronpozitivitással. A diagnosztikai, sebészi, sugárterápiás elvek és a kemoterápia közel megegyeznek a női emlődaganatok ellátásával. A szakmai ajánlások adjuváns és terápiás kezelés során tamoxifent és egyéb szelektív ösztrogénreceptor-modulátort javasolnak. Nagy nemzetközi adatbázisok alapján a túlélési adatok különböznek a férfi és a női emlődaganatos betegek között. Új biomarkerek, genetikai vizsgálatok vannak folyamatban, amelyek alapján jobban megismerhetővé válik a férfi emlődaganat.
Hogyan befolyásolja a BRCA-státusz az emlőrák ellátását 2019-ben?
A germinalis BRCA-státusz korai vagy előrehaladott/áttétes emlőrákban egyaránt befolyásolja az ellátás menetét. Így ideális esetben a beteg informáltan dönthet a műtét típusáról, a sugárkezelés elkerüléséről; a BRCA-státusz a legújabb eredmények alapján befolyásolja a neoadjuváns, adjuváns, palliatív kemoterápia megválasztását, továbbá új, hatékony célzott (target) terápia alkalmazását vetheti fel. Specifikus terápiának számítanak a DNS-támadáspontú citosztatikumok, mindenekelőtt a platinakészítmények és a szintetikus letalitás elve alapján ható PARP-inhibitorok. E speciális gyógyszercsoportok optimális helye és sorrendje egyelőre nem ismert. A nemzetközi ajánlások valamennyi HER2-negatív (NCCN) vagy legalább a mutatók alapján valószínű BRCA-mutációt hordozó (ESMO) előrehaladott/áttétes emlőrákos esetben sürgetik a BRCA-státusz-vizsgálatot a megfelelő terápiás stratégia meghatározása érdekében. Az elmúlt időszakban a BRCA-státusz meghatározására szolgáló módszerek óriási fejlődésen mentek át, és egyre szélesebb körben elérhetőek különféle szolgáltatók kínálatában. A mutáció azonosításához a teljes gének szekvenálása szükséges, amelyre a korábbi módszereknél gyorsabb és költséghatékonyabb megoldást nyújt az új generációs szekvenálóplatformok (next generation sequencing - NGS) alkalmazása. A kezelőorvos felelőssége, hogy amennyiben a részletes családi anamnézis, a beteg életkora, esetleges megelőző daganatos betegsége és nem utolsósorban a daganatjellemzők alapján felmerül, gondoljon patogén BRCA-mutáció jelenlétére, mérlegelje a teszt indokoltságát, illetve vesse fel a beteg számára a lehetőséget.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.