Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Klinikai Onkológia - 2022;9(3)
Tartalom
Hírek a világból
Az ismert, hogy az androgének gátolják a T-sejtek IFN-γ-termelését. Kísérleti rendszerben az androgénblokád megemeli az IFN-γ-termelést. Az azonban nem volt világos, hogy befolyásolják-e az mCRPC ICI iránti érzékenységét az androgének. A klinikai kutatásban prosztatabiopsziás mintákat elemeztek, amelyeket egy enzalutamid és pembrolizumab kombinációs klinikai vizsgálatból nyertek. Nyolc beteg mintáját dolgozták fel, ebből három reszponder volt, míg öt nem. A CD8 T-sejtek denzitásában nem volt eltérés a két betegcsoport között a daganatokban. Ugyanakkor a genetikai elemzés kimutatta, hogy a tumorasszociált T-sejteket két csoportra lehetett osztani génexpressziós profil alapján: a reszponderekben citotoxikus gének domináltak, míg a nem reagálók esetében a T-sejtek nyugalmi/blokkolt állapotra jellemzőeket fejeztek ki, ezzel párhuzamosan magasabb volt az androgénszintjük is. A kutatók felfedezték, hogy az IFN-γ-gén promoterében androgénreszponzív elemek vannak. Az enzalutamiddal fel lehetett függeszteni a T-sejtek csökkent IFN-γ-termelését, amit az androgénkezelés váltott ki. Amennyiben az anti-PD1-et enzalutamiddal kombinálták, a T-sejtek különböző funkciói jelentősen javultak. Kísérleti prosztatarákmodellben az enzalutamid és anti-PD1 kombinációs kezelés hatékonyabbnak bizonyult, mint a kétféle terápia önmagában.
Az Amerikai Klinikai Onkológiai Társaság 2022-es kongresszusának legfontosabb újdonságai
Az idei ASCO-kongresszuson korai emlőrák kapcsán alapvető paradigmaváltó vizsgálat nem került közlésre, korábbi eredmények megerősítése, azok pontosítása történt. A 2021-es ESMO-konferencián a MonarchE vizsgálat (1) legfrisseb analízise egyértelműen standard választható kezeléssé emelte az adjuváns abemaciclibkezelést hormonterápiával kombinálva magas rizikójú korai hormonpozitív emlőtumor (N2 státusz vagy N1+grade 3/T3-T4/magas Ki-67) esetében (több mint 5%-os abszolút előny invazív betegségmentes túlélés kapcsán). Ezzel szemben a PALLAS vizsgálat adjuváns palbociclib kapcsán nem tudott igazolni hasonló előnyt. Utóbbi studyt illetően az idei konferencián felvetették azt, hogy a túlsúly, illetve obesitas befolyásolhatja a palbociclib hatékonyságát, azonban ez nem került bizonyításra, egyik alcsoportban sem tudtak érdemi előnyt igazolni.
A pajzsmirigyrákok molekuláris diagnosztikája és kezelése
A pajzsmirigydaganatok a leggyakoribb rosszindulatú endokrinológiai kórképek. A betegségcsoport diagnosztikai és kezelési szemlélete az utóbbi években jelentős átalakuláson ment keresztül. Az eddig alkalmazott klasszikus diagnosztikai algoritmusok kiegészültek az egyre szélesebb spektrumú és egyre könnyebben elérhető molekuláris diagnosztikai lehetőségekkel, amelyeknek köszönhetően a választott kezelés specifikusabb gyógymódot jelenthet a betegek számára. Ennek eredményeképp a visszatérő, kiterjedt kórállapotokban a molekuláris célpontú terápiák mára elkezdték kiszorítani a szisztémás kemoterápiákat a kezelési irányelvekből és sok esetben előléptek másodvonalbeli kezeléssé. Egyértelmű tehát a téma klinikai jelentősége és aktualitása, így jelen közleményünkben igyekszünk átfogó képet nyújtani a pajzsmirigyrák egyes szövettani altípusainak legkorszerűbb molekuláris diagnosztikájáról és kezelési stratégiáiról.
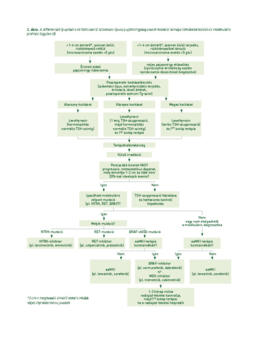
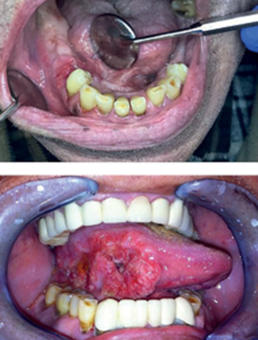
A szájüregi daganatok korszerű kezelése
Magyarországon a szájüregi malignus daganatok száma igen magas. A legfontosabb etiológiai tényezők a dohányzás és alkoholfogyasztás, valamint kisebb mértékben a humán papillomavírusok (HPV) által okozott orális fertőzés. Bár a korai detektálás viszonylag egyszerű, előrehaladott betegség gyakran előfordul. A diagnózishoz és a stádium pontos meghatározásához fizikális, eszközös és képalkotó vizsgálatok szükségesek, amelyek eredménye előrevetíti a túlélést, és meghatározza a további terápiás opciókat. A szájüregi daganatok onkológiai kezelésében az elmúlt 30 évben a diagnosztika és multidiszciplináris terápia túlélésnövekedést, a komplex dentoorális gondozás, valamint a műtéti rekonstrukció fejlődése életminőség-javulást könyvelhet el. A legjobb gyógyeredményeket továbbra is a posztoperatív kemoradioterápiával kiegészített sebészi terápia adja. A táplálkozásban, beszédképzésben és a fej-nyaki régió esztétikájában betöltött fontos szerepe miatt a szájüregi daganatok sebészi kezelése és jó funkcionális eredményekkel történő műtéti rehabilitációja speciális felkészülést igényel. Lokoregionális relapsusok és távoli metasztázisok kezelésében meghatározóvá vált az immunterápia (pembrolizumab, nivolumab) akár monoterápiában, vagy kemo/sugár terápiával kombinálva. A jövőben további biomarkerek, endogén és mikrokörnyezeti faktorok feltérképezése segítheti a hatékony, személyre szabott kezeléseket.
RET-módosult rákok precíziós terápiája RET-gátlókkal
A RET részt vesz egyes szervrendszerek élettani fejlődésében. A RET-módosulások akár génfúziók vagy akár pontmutációk révén történő aktiválása erős onkogén driver a nem kissejtes tüdőrákban, a pajzsmirigyrákban és különböző egyéb rákos megbetegedésekben. RET-módosult daganatokat kezdetben multikináz-inhibitorokkal (MKI) kezelték. Az MKI-k hatékonysága szerény volt, toxicitásuk pedig jelentős az off-target aktivitásuk miatt. A közelmúltban a rendkívül erős és RET-specifikus inhibitorok, a szelpercatinib és a pralszetinib sikeresen átkerültek a klinikai gyakorlatba és az FDA jóváhagyta ezeket a készítményeket. Összefoglaljuk a jelenlegi legmodernebb terápiás módszereket ezen új RET-gátlók preklinikai és klinikai adatainak és a szerzett rezisztenciamechanizmusok, valamint a jövőbeli kilátások áttekintésével.
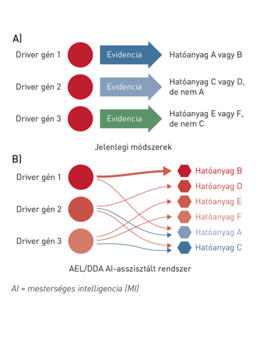
Mesterséges intelligenciával támogatott digitális terápiatervezés a precíziós onkológiában
A precíziós onkológiai megközelítés mára a rutinellátás részévé vált. Egyre több daganatos betegnél készül több száz génes molekuláris diagnosztikai vizsgálat, és több mint 100 célzott vagy immunterápiás gyógyszer van forgalomban. A megnyíló lehetőségek mellett ez kihívást is jelent, hiszen sok esetben több célzott terápiás kezelési lehetőség is rendelkezésre áll ugyanahhoz a biomarkerhez kapcsolódóan, a daganatban párhuzamosan jelen lévő – átlagosan négy-öt – genetikai eltérések módosíthatják a célzott terápiák hatásosságát, sőt egyre több esetben több célozható alteráció is kimutatható egy daganatban. Ilyen esetekben az optimális terápiás terv kialakítása jelenleg a molekuláris tumor boardok (MTB) felelőssége. Azonban több tanulmány kimutatta, hogy komplex molekuláris profilok esetén az MTB-k terápiás javaslata nagyon alacsony konkordanciát mutat. Automatizált döntéshozási módszerekre van szükség, hogy a döntéshozatal hatékonysága mérhetővé váljon, így a metódusok egymással összehasonlíthatók legyenek, és a betegek validált módon a leghatékonyabb döntési módszer alapján juthassanak kezeléshez. A digital drug assignment (DDA) algoritmus lehetőséget nyújt a terápiás döntések standardizálására, ha több célzott vagy immunterápiás kezelési lehetőség áll rendelkezésre, és más iránymutatás nem tesz különbséget a kezelésektől várható klinikai előny tekintetében. A módszer klinikai hasznosságának és biztonságosságának vizsgálata a SHIVA01 klinikai vizsgálat adatain történt.
Daganatos betegség a Covid és háború idején – Pszichológiai összefoglaló
A daganatos betegséggel érintetteknek eddig is sok kihívással kellett szembenézniük hétköznapjaikban. Azonban a Covid-19-világjárvány, majd az orosz–ukrán háborús helyzet még több megpróbáltatást hozott számukra. A vírus és a háború az alapvető fizikai biztonságukat és szükségleteiket ingatta meg. Ilyen időszakban kiemelkedően fontos pszichés támogatás nyújtása a sérülékeny populációknak, mivel szorongásos és depressziós zavarok is kialakulhatnak a folyamatos bizonytalanság, aggodalom és szociális izoláció talaján. Ez a pszichológiai összefoglaló cikk azt a célt szolgálja, hogy támpontokat nyújtson daganatos betegek részére, illetve bárki számára, aki úgy érzi, hogy eluralkodik rajta a vírustól való félelem, a társadalmi problémák és nem tudja, hova fordulhat segítségért.
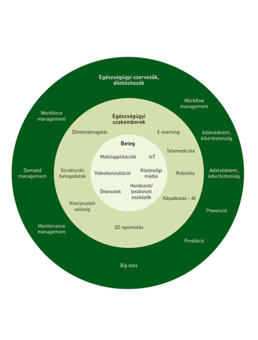
Patológia határok nélkül: Digitális patológia – telepatológia
Az egészségügyi digitalizáció, azon belül is a patológiai tevékenységek digitalizációja korábban elképzelhetetlen lehetőségeket és előnyöket rejt magában. A következőkben áttekintést adunk a digitális patológia területeiről, rutindiagnosztikai alkalmazásáról, a munkafolyamatokat támogató információtechnológiai fejlesztésekről és döntéstámogató rendszerekről. A digitális patológia általános ismertetése után, a Semmelweis Egyetem Patológiai és Kísérleti Rákkutató Intézetben történt fejlesztések kapcsán, konkrét példákon keresztül mutatjuk be digitális rendszereink működését. Nincs még egy olyan terület a medicinában, mint az onkológia, ahol a patológia szerepe az elmúlt években jobban felértékelődött volna. A digitális patológiai fejlesztések döntő része, ennek megfelelően az onkológiai ellátás minőségjavulását is eredményezi. Ezek közé tartozik a patológiai strukturált leletezés, intraoperatív távdiagnosztika lehetősége, automatizált biomarker-vizsgálatok célzott támadáspontú gyógyszerek indikálásához vagy népegészségügyi szűrőprogramok esetében, a vizsgálati minták standard feldolgozását követően a minták értékelése a digitális térben összekapcsolt patológusi munkacsoportok által. Az említett példák mind olyan fejlesztések, ami az általában elvárható minőségjavulás mellett hozzájárulnak a területi egyenlőtlenségek felszámolásához, legalábbis a diagnosztika területén. Jól felépített digitális patológiai adatbázisokból automatikusan nyerhetők historikus és naprakész adatok, például az onkológiai jellegű morbiditásról, mortalitásról vagy friss információt kaphatunk arról, hogy adott időintervallumban milyen kapacitásterhelésre számíthat az onkológiai ellátórendszer a primer patológiai diagnózisok függvényében.
1.
2.
3.
4.
5.
1.
2.
Ideggyógyászati Szemle Proceedings
A Magyar Stroke Társaság XVIII. Kongresszusa és a Magyar Neuroszonológiai Társaság XV. Konferenciája. Absztraktfüzet3.
4.
5.
Egészségpolitika
A MOK és a MOSZ további lépéseket tesz a szakma és a biztonságos betegellátás érdekében