A spinalis izomatrophia személyre szabott terápiás lehetőségei
SZABÓ-TAYLOR Katalin, MOLNÁR Mária Judit
2023. MÁRCIUS 30.
Ideggyógyászati Szemle - 2023;76(3-4)
DOI: https://doi.org/10.18071/isz.76.0077
Összefoglaló közlemény
Review
SZABÓ-TAYLOR Katalin, MOLNÁR Mária Judit
2023. MÁRCIUS 30.
Ideggyógyászati Szemle - 2023;76(3-4)
DOI: https://doi.org/10.18071/isz.76.0077
Összefoglaló közlemény
Review
Szöveg nagyítása:

5q spinalis izomatrophia (gerincvelői izomsorvadás)
Genetika
Az 5q spinalis izomatrophia (5qSMA) progresszív neurodegeneratív kórkép, ami a cystás fibrosist követően a második leggyakoribb autoszomális recesszív betegség a kaukázusi populációban1 . Világszerte 1:6000-1:10000 közé tehető az SMA-val világra jövő gyermekek aránya, de bizonyos populációkban ez az arány még magasabb. Az 5-ös kromoszóma hosszú karjának SMN-t magába foglaló régiója igen dinamikus, így nagyon sokféle duplikációs, konverziós, mutációs esemény történt itt az evolúció során, illetve történhet de novo. A betegséget az esetek körülbelül 95%-ában az SMN1 gén (ami a „survival motor neuron”- [SMN] fehérje kódolásáért felelős) homozigóta deléciós variánsai (többnyire a 7-es exon vagy a 7-es és 8-as exon deléciója) okozzák a kaukázusi populációban2. Bizonyos népcsoportoknál, például az afrikai fekete lakosság körében más patogén variánsok jellemzőek, így ezeknél a betegeknél nemcsak az Európában és USA-ban hagyományosan használt genetikai tesztek adnak nagyon gyakran hamis negatív eredményt, hanem a klinikai prezentáció is eltérhet a kaukázusinál megszokottól3 . Az SMN-fehérje teljes hiánya embrionálisan letális, az embernél azonban létezik egy paralóg génkópia, az SMN2, ami megmentheti a fenotípust. Az SMN2 néhány bázispáreltérést mutat az SMN1-hez képest, azonban egy transzlációsan csendes mutáció elront egy ESE-szekvenciát (exonic splicing enhancer), és helyette egy ESS-szekvenciát (exonic splicing silencer) hoz létre, ami azt eredményezi, hogy a 7-es exon csak kis százalékban íródik át a fehérjébe. A 7-es exon nélküli SMN-fehérje nem stabil, hamar degradálódik, de a kis mennyiségben az SMN2-ről képződő normális szerkezetű SMN lehetővé teszi, hogy homozigóta SMN1-deléció mellett is megszülessen az érintett magzat2 . Magasabb SMN2-kópiaszám nagyobb mennyiségű SMN-termelést, így enyhébb fenotípust eredményez. Ebből adódóan az SMN2 kópiaszámának (0–8 között változik, leggyakrabban 2 [az apai és anyai 5-ös kromoszómán is 1-1 kópia]), és az egyéb módosító tényezőknek függvényében alakulnak ki az eltérő súlyosságot mutató SMA-formák. Ezek a következők: igen súlyos („SMA 0”), súlyos („SMA1”), átmeneti („SMA2”), enyhe („SMA3”) és felnőttkori („SMA4”) típus. A számos egyéb módosító genetikai és nem genetikai tényező miatt az SMN2 gén kópiaszáma és az SMA tüneteinek súlyossága közötti korreláció nem szoros, klinikai következtetések levonására korlátozottan alkalmas4 .
Az SMA hátterében álló SMN1-deléciók, mutációk tehát változatosak. Az SMA1 fenotípusú érintettek többnyire valódi SMN1-deléciót hordoznak. Az enyhébb, 2–4 fenotípusú betegeknél ezzel szemben gyakran egy génkonverzió eredményeként az SMN1 gén SMN2-vé konvertálódik, ami az SMN2 kópiaszám emelkedésével jár. Az SMA-val élők 2%-ánál viszont de novo SMN1 deléció áll a betegség hátterében. Az SMN2 is deletálódhat, ez azonban SMN1 deléció hiányában nem jár fenotípusos változással. Génkonverzió fordítva is előfordulhat, azaz az SMN2 is konvertálódhat SMN1-gyé. Ennek megfelelően vannak három vagy több SMN1-kópiát hordozó egyének, akiknél ez fenotípusosan nem jelenik meg, azonban náluk idősebb korban nagyobb a késői motoneuron-betegségek (például ALS) megjelenésének rizikója2 . Tovább bonyolítja a képet az úgynevezett 0 + 2 és 0 + 3 hordozók léte, akiknél két vagy három SMN1 kópia helyezkedik el az egyik 5-ös kromoszómán, míg a másikon egy sem. Így ők fenotípusosan nem feltűnőek, és rutin szűrő genetikai teszttel sem azonosíthatók, úgynevezett „csendes hordozók”5 . Az SMN1 pontmutációit hordozó egyének is csendes hordozók, mivel rutin szűrővizsgálatokon ők sem kerülnek detektálásra5.
Módosító genetikai tényezők az SMN2 kópiaszám mellett az SMN1 és SMN2 gén különböző variánsai, illetve egyéb, SMN-től független gének. Az SMN2 génen két olyan variánst írtak le, melyek pozitív módosítóként hatnak, azaz a kópiaszám alapján várhatónál enyhébb fenotípus megjelenését okozzák. Az egyik a c.859G>C a 7-es exonon, ami feltehetőleg egy új ESE-helyet alakít ki, a másik a c.835-44A>G a 6-os intronban, ami egy splicing represszor fehérje kötődésének mértékét csökkenti6.
SMN-független módosító gén a NAIP (neuronal apoptosis inhibitory protein), ami az SMA1-betegek közel 70%-ánál deletálódott. A fehérjének a motoneuronpusztulás (ami a születés utáni fiziológiás folyamat része) megakadályozásában van szerepe2 . Protektív módosító gének a plastin 3 (PLS3) és a neurocalcin delta (NCALD)2.
Ezért kizárólagosan csak az SMN2-kópiaszám alapján nem lehet a betegség lefolyását egyértelműen prognosztizálni: minden ismert genetikai és nem genetikai modifikáló faktort figyelembe kell vennünk a terápia választásánál.
Az SMN-fehérje
Az SMN számos sejttani folyamat szabályozásában vesz részt, a teljesség igénye nélkül ismert például szerepe az snRNS (small nuclear RNS) és a microRNS biogenezisében, a splicing és a DNS-hibajavítás mechanizmusában, az aktin dinamikájában és az endocitózisban7. A motoneuronokban ezen kívül specifikus szerepet is játszik az mRNS axonalis transzportjában és a transzlációban2 . Bár az SMN-fehérje ubikviter, a központi idegrendszerben szükséges belőle a legnagyobb men nyiség. SMA-ban különösen a gerincvelő elülső szarvának és az agytörzsnek az α-motoneuronjai érintettek, így ezek pusztulnak el leghamarabb a betegség során. Jellemző azonban egy úgynevezett küszöbeffektus: a normális mennyiség körülbelül 20%-ánál kisebb mennyiségnél (mint ami a 2 SMN2 kópiás egyénekre jellemző kezelés nélkül) megjelenik az egyéb szervek (például cardiovascularis rendszer, pancreas) érintettsége. Ki kell emelni, hogy az egyéb szervi érintettség nem feltétlen manifesztálódik kisgyermekkorban2.
A legnagyobb SMN-mennyiségre perinatalisan van szükség8, ami azt jelenti, hogy az SMN hiánya következtében a praenatalis fejlődés is érintett lehet, ami miatt a motoneuronok mellett a neuromuscularis junkció (NMJ) és a vázizmok fejlődése is eltérhet az egészségestől9 . Ezért fontos, hogy a tünetmentes gyerekek is minél hamarabb részesüljenek kezelésben10. A perinatalis terápiás ablakon belül csaknem teljesen megelőzhetők a súlyos klinikai tünetek, ennek elmulasztása esetén azonban már nem lehet tünetmentes állapotot elérni egyik terápiával sem2 . Arra vonatkozóan azonban nem rendelkezünk tapasztalattal, hogy ha tünetmentesen kezelünk négy SMN2 kópiás beteget, a terápiás ablakon túl is szükséges-e a kezelés folytatása, vagy esetleg kezelési szünet is beiktatható, ha RNS vagy kismolekula alapú terápiát kapott a beteg.
SMN-t célzó terápiás lehetőségek Jelenleg három, az SMN szintjét specifikusan növelő gyógyszer áll az SMA-betegek rendelkezésére, a nuszinerszen (Spinraza), az onaszemnogén abeparvovek (Zolgensma) és a riszdiplám (Evrysdi). Mindhárom gyógyszerrel számos klinikai vizsgálat zajlott, elsőként szimptómás SMA1 típusú csecsemők körében, majd vizsgálatok indultak szimptómás 2–3. típusú egyének, illetve preszimptómás csecsemők körében is. A vizsgálatok különböző életkorú és típusú SMA-betegek terápiás válaszait és a készítmények mellékhatásait elemezték (1. táblázat). A klinikai vizsgálatok részletes tárgyalása messze túlmenne a jelen összefoglaló mű keretein. Ugyanakkor a klinikai vizsgálatok jelentőségét – bár kétségkívül fontos szerepük van a kezdeti dózisoptimalizálás, a biztonságosság és hatékonyság megállapítása és a gyógyszer engedélyeztetése szempontjából – ritka betegségek esetén nem szabad túlbecsülni. Az 1. táblázatból kitűnik, hogy a klinikai vizsgálatok korlátozott számú résztvevőjéhez képest mostanra a „real-world” adatok sok ezer betegről állnak rendelkezésre11–13. Azaz a valós klinikai populáció körében tapasztalt hatásosságról és mellékhatásokról is jóval reálisabb képet kaphatunk a „real-world” adatok elemzése által. Éppen ezért elengedhetetlenek a precízen vezetett, nemzetközi összehasonlításra is alkalmas regiszterek. A 2. táblázat röviden bemutatja a betegek követésére használt motoros skálákat14–19.
1. táblázat. A három SMN-t célzó betegségmódosító terápia klinikai vizsgálatai, és a klinikai vizsgálatokban és a valós életben kezelt egyének hozzávetőleges száma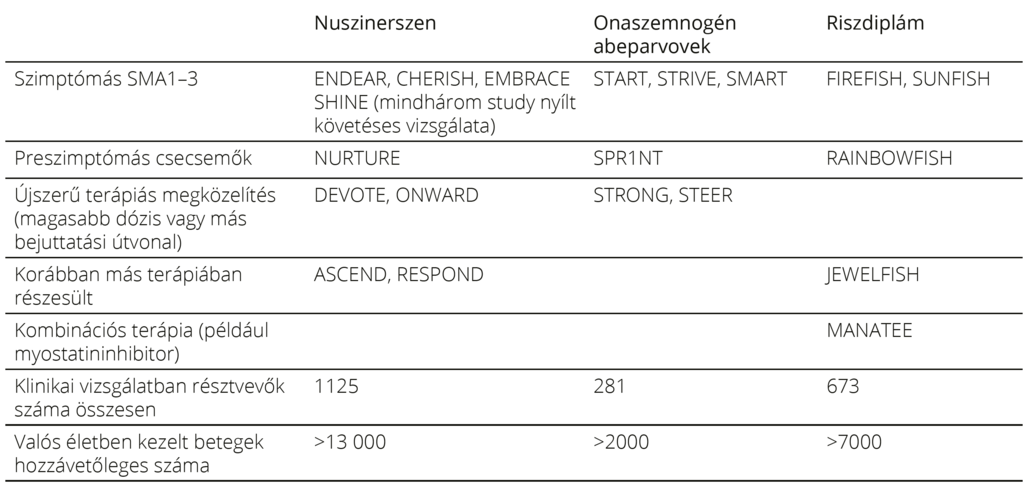
Nuszinerszen (Spinraza)
Molekuláris mechanizmus és kezelési protokoll
Az FDA 2016-ban, az EMA 2017-ben hagyta jóvá az SMA betegség első módosító kezelését, a nuszinerszent. A nuszinerszen egy 18 nukleotidból álló antiszenz oligonukleotid (ASO), ami az SMN2 gén 7-es intronrégiójához kötődve módosítja a pre-mRNS splicing mechanizmusát, ami által a 7-es exon körülbelül 70%-ban átíródik, és így a nuszinerszen az SMN2 kópiaszámától függően emeli az SMN fehérje szintjét. A nuszinerszent négy feltöltő adagot követően (0., 14., 28. és 63. napon), négyhavonta intrathecalisan jutattják a liquorba (mint ASO, nem jut át a vér-agy gáton, így közvetlenül a cerebrospinalis folyadékba kell bejuttatni)20.
2. táblázat. A betegek követésére használt motoros skálák rövid leírása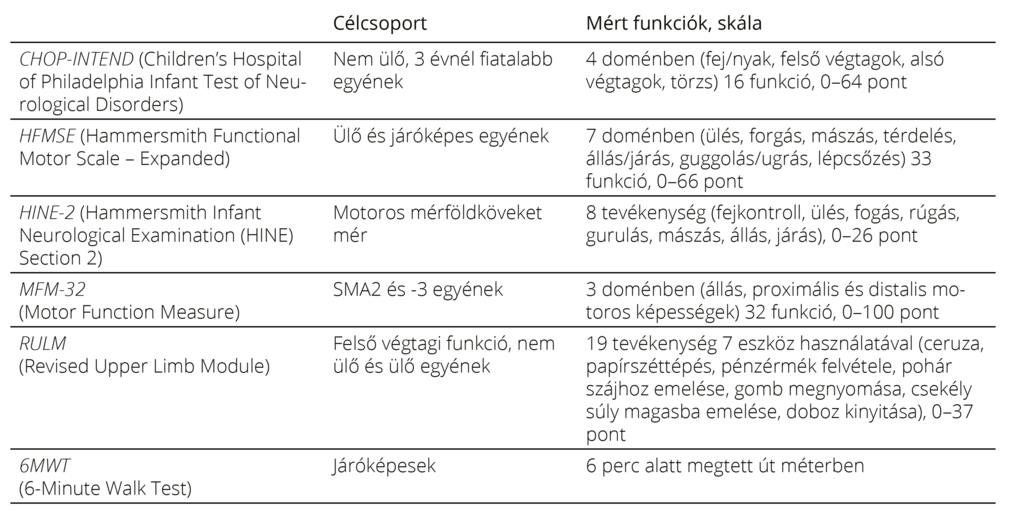
Klinikai vizsgálatok
Az engedélyezéséhez az ENDEAR és CHERISH vizsgálatok eredményeit használta a fejlesztő, melyekben különböző életkorú, és klinikai súlyosságú SMA-s csecsemőket és gyermekeket vizsgáltak (3. táblázat). Az ENDEAR a nuszinerszen hatékonyságát és biztonságosságát vizsgálta tünetes SMA1-es 7 hónaposnál fiatalabb, két SMN2 kópiával rendelkező csecsemőknél. A dózist (12 mg) egy megelőző II-es fázisú tanulmány során állapították meg. Később a vizsgálatot az EMBRACE keretein belül kiterjesztették olyan gyermekekre is, akik az ENDEAR és a CHERISH kritériumainak nem feleltek meg. Az ENDEAR, CHERISH és EMBRACE vizsgálatok résztvevői valamennyien bekapcsolódhattak a SHINE nyílt követéses vizsgálatba, aminek tervezett záró időpontja 2023. augusztus20.
SCEND és SHINE klinikai vizsgálatok folynak. A NURTURE keretein belül 5q-asszociált SMA genetikai diagnózissal rendelkező preszimptómás csecsemőket kezelnek. Az első nuszinerszeninjekciót 6 hetes kor előtt kapják meg a csecsemők21.
A RESPOND és az ASCEND tanulmányok olyan betegeket vizsgálnak, akik korábban onaszemnogén abeparvovek-, illetve riszdiplámterápiában részesültek, a DEVOTE pedig magasabb dózisú nuszinerszen hatását vizsgálja. A DEVOTE vizsgálat első, biztonságosságot elemző „A” fázisa lezárult, és az adatok szerint a magasabb dózisú nuszinerszen nem járt újabb biztonságossági aggályokkal, a vizsgálat során előfordult adverz reakciók az alapbetegséghez vagy a lumbáláshoz voltak köthetők, a mellékhatásprofil megegyezett a befogadott dózishoz köthetővel22. A nuszinerszen lezárult klinikai vizsgálatait23 a 3. táblázat foglalja össze.
3. táblázat. A nuszinerszen lezárult klinikai vizsgálatai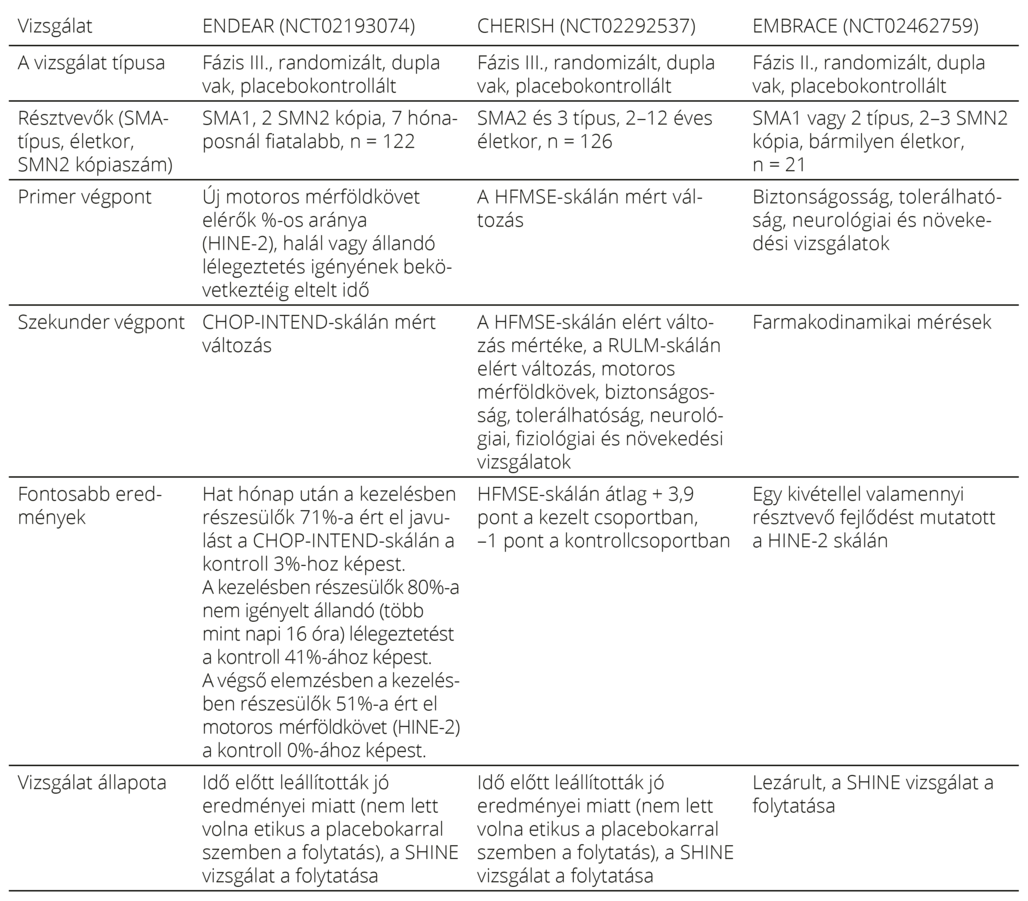
„Real-world” adatok
Az eredeti engedélyezést követően világszerte több mint 13 000 beteg részesült nuszinerszenkezelésben11, így a „real-world” adatok mára bőségesebb és kiegyensúlyozottabb képet adnak a nuszinerszen hatékonyságáról és biztonságosságáról, mint a kis elemszámú klinikai vizsgálatok. Ennek megfelelően a készítmény biztonságossága nem csökkent, a súlyos mellékhatások nagyon ritkák, és többnyire a lumbálpunkcióhoz köthetők. A nuszinerszenkezelések a klinikai tapasztalatok szerint a betegek többségénél javulást vagy a betegség stabilizálódását eredményezték.
Egy metaanalízis 11 kezelőcentrum 428 felnőtt és serdülő (12–18 éves) SMA-betegének legalább 6 hónapos követési idővel elvégzett nuszinerszenkezelései dokumentációjának elemzése során a felnőtt betegeknél – akik funkcionális motoros skálákkal monitorozhatóak voltak – statisztikailag szignifikáns javulást talált bizonyos motoros skálákon (HFMSE, RULM), míg a 6MWT stabilizálódást mutatott24. A tüdőfunkció vonatkozásában egyes közlemények bizonyos skálákon mutatott javulást (peak cough flow, Forced Expiratory Volume in 1s [FEV1 ]) riportálták, a metaanalízis során pedig stabilizálódást (Forced Vital Capacity [FVC]) találtak. Az esetek zömében csak a lumbáláshoz köthető enyhe mellékhatások jelentkeztek (fejfájás, hátfájás), az esetek 2%-ánál jelentkezett súlyos mellékhatás (húgyúti komplikációk, meningitis, epilepsziás roham).
Egy másik átfogó közlemény 400 publikált tanulmány adatai alapján végzett metaanalízist a 2–3. típusú SMAbetegek (felnőtt, gyermek, járóképes és nem járóképes) nuszinerszenkezelésének eredményeiről, és konzisztens javulásról számol be a különböző motoros skálákon25. Ezek a tanulmányok ráirányítják a figyelmet, hogy a nuszinerszen hosszabb ideje fennálló betegség esetén is értékes, hatékony és jól tolerálható terápia. A fent említett metaanalízisek mellett több kisebb tanulmányt is közöltek a nuszinerszenkezeléssel kapcsolatos „real-world” tapasztalatokkal26.
Lehetséges mellékhatások
A nuszinerszennel kapcsolatos mellékhatások többnyire a lumbálpunkcióhoz köthetőek (posztpunkciós fejfájás, a liquor szivárgása, többszöri anesztézia, illetve sugárterhelés), a súlyos mellékhatások esélye (például meningitis, a VI. agyideg átmeneti paralysise) gondos alkalmazás mellett minimális. Az egyéb ASO-knál előforduló mellékhatások (vesetoxicitás, thrombocytopenia) a nuszinerszennél nem, vagy igen ritkán és enyhe mértékben lépnek fel, biztonságossági profilja kitűnő27. Súlyos gerincdeformitással élő betegeknél gondot okozhat a lumbálpunkció. Ilyenkor alternatíva lehet a ciszternapunkció. Felnőtt betegeknél a két kezelés közötti időszakban hatásgyengülésről („wearing-off effect”) számoltak be, ami elsősorban a magasabb testsúlyú betegekre jellemző28. Ezért fut jelenleg többek között az emelt dózisú kezelés hatásait elemző DEVOTE vizsgálat.
Szisztémás szövetekre gyakorolt hatás
A nuszinerszennel kapcsolatban felmerül, hogy egy központi idegrendszerbe adott gyógyszernek lehet-e szisztémás szövetekre gyakorolt hatása. A nuszinerszen alapvetően a központi idegrendszerben oszlik el, de kis mennyiségben kijut a szisztémás szövetekbe is. A gerincvelőben a nuszinerszen a legmagasabb koncentrációt a lumbalis régióban éri el, a myelonban caudalis irányban csökken koncentrációja. Feltehetőleg ezzel magyarázható a súlyosabb SMA-s betegeknél a javuló motoros funkciók mellett perzisztáló bulbaris gyengeség29.
A központi idegrendszeri adagolás ellenére, a nuszinerszennek átfogó hatása van a szisztémás szervek működésére is. A CSF-metabolitok mérésén keresztül alátámasztották, hogy a nuszinerszenkezelésben részesülő SMA-s egyéneknél jelentős változások mérhetők az aminosav-anyagcserében. Súlyos típusoknál ezen kívül a glükózmetabolizmusban is kedvező változások lépnek fel, míg átmeneti típusnál a zsírsavanyagcsere változását mérték. Feltehetőleg a nuszinerszen a neurotranszmittermetabolizmusra gyakorolt stimuláló hatásán keresztül közvetlen hatással van az egész neuromuscularis rendszerre, és az ideg-izom szinapszisok funkcionális javítása által közvetetten a máj és a zsírszövet működésére is jótékony hatású30. A szerzők felvetik azt a lehetőséget, hogy a nuszinerszenterápia hatékonyságát aminosavak étrendi kiegészítése útján lehetne fokozni30. A tartós nuszinerszenkezelés hatása az izmokon is mérhető: DTI- (diffusion tensor imaging) technikával az izomrostok számának, hosszúságának és szerkezetének javulását figyelték meg SMA3-betegeken31. A légzésfunkciót illetően a legtöbb közlemény stabilizálódásról vagy javulásáról számol be32.
EMA-törzskönyv és hazai hozzáférés
Az EMA-törzskönyv alapján a nuszinerszen bármilyen életkorú 5q-SMA-betegnél alkalmazható, megkötés nélkül20. Magyarországon 2018 áprilisa óta érhető el 18 év alatti SMA-betegek részére, egyedi méltányossági alapon. A felnőtt betegek számára 2021. óta érhető el közfinanszírozottan a gyógyszer. 2023. februári állapot szerint 109, SMA-val élő egyén részesül nuszinerszenterápiában hazánkban. A hazai nuszinerszenkezelés első két évének tapasztalatairól Szabó és munkatársai számoltak be33. Közeményükben főleg gyermekekről szerzett tapasztalatokról olvashatunk. A szerzők a kezelt betegek motoros fejlődéséről számolnak be, új biztonságossági aggály nem merült fel a készítménnyel kapcsolatban. A hazai felnőtt SMA-betegek nuszinerszenkezelésével kapcsolatos tapasztalatokat írásos közlemény formájában még nem összegezték, az adatokat a Magyar Klinikai Neurogenetikai Társaság 2022. évi Konferenciáján hallhattuk. A nuszinerszen hazai bevezetésével párhuzamosan került sor a hazai SMA-diagnosztikát és -menedzsmentet szabályozó szakmai irányelvek kidolgozására34.
Onaszemnogén abeparvovek (Zolgensma)
Molekuláris mechanizmus és kezelési protokoll
Az onaszemnogén abeparvovek egy adenoasszociált vírus- (AAV9) vektor alapú terápia, ami egyszeri intravénás infúzióval bejuttatva eljut a különböző szövetekbe. Az SMN1-transzgén episzomálisan, azaz a gazdasejt genomjába nem beépülve helyezkedik el a sejtmagban, és ott történik meg az SMN1 fehérje transzlációja35.
Klinikai vizsgálatok Az onaszemnogén abeparvovek hatásosságát és biztonságosságát a STR1VE, SPR1NT és START klinikai vizsgálatok során vizsgálták. Az EMA a klinikailag SMA1-gyel diagnosztizált betegek, illetve a legfeljebb 3 SMN2 kópiás, biallélikus SMN1 delécióval rendelkező 5q-SMA-betegek számára hagyta jóvá12, 35.
Az 1-es fázisú START vizsgálat során 15 szimptómás, két SMN2 kópiával rendelkező csecsemőt kezeltek, hármat biztonságossági okból FDA-ajánlásra alacsonyabb, szubterápiás dózissal (6,7 × 1013 vektorgenom/ttkg), tizenkettőt terápiás dózissal (2,0 × 1014 vektorgenom/ttkg). A gyermekek fejlődését természetes betegséglefolyással hasonlították össze. A kezelést követő 24. hónapban valamennyi gyermek életben volt, egyikük sem igényelt invazív lélegeztetést. A magasabb dózisú kezelésben részesülők átlag CHOP-INTEND-eredménye 56,5 volt; minél korábban kapták a kezelést és minél magasabb volt a kezdeti CHOP-INTEND-érték, annál jobb eredményt értek el a magasabb dózisú kezelésben részesülők. A tanulmányban részt vevő gyermekek közül 13-at további 15 évig terveznek követni. Az 5 éves követési eredmények alapján a 10 gyermek, aki a terápiás dózist kapta, megtartotta az első 24 hónapban elért funkcióit, sőt kettő esetében nuszinerszenkezelés nélkül is megjelent új funkció (állás támasszal)36. A hosszú távú követés interpretációját bonyolítja, hogy három, szuboptimális dózisú kezelésben részesülő gyermek, illetve négy, terápiás dózisú kezelésben részesülő gyermek fenntartó nuszinerszenkezelésben is részesül. A csecsemők CHOP INTEND-pontszáma nagyon szórt a génterápia beadásakor. Az alacsony CHOPINTEND-pontszámmal rendelkező gyermekeknél értek el kisebb mértékű javulást. Ez a tény is alátámasztja azt a megfigyelést, hogy a génterápia is akkor hatásos, ha a betegség nagyon korai, illetve lehetőség szerint tünetmentes állapotában alkalmazzuk. Ezt támasztotta alá a SPR1NT tanulmány is. A 3-as fázisú STR1VE vizsgálat az onaszemnogén abeparvovek terápiás dózisának (1,1 × 1014 vektorgenom/ttkg) hatásosságát és biztonságosságát vizsgálta (4. táblázat).
A SPR1NT (NCT03505099) vizsgálat az újszülöttszűrés során diagnosztizált, tünetmentes újszülötteket vizsgálta, a STRONG (NCT03381729) és STEER (NCT05089656) vizsgálatok idősebb, SMA1 és SMA2 típusú betegek esetében vizsgálja az intrathecalis génterápiás kezelés lehetőségét, a SMART (NCT04851873) pedig a génterápia 12 hónapon túl mérhető hatásait 8,5–21 kg testsúlyú SMA1-gyermekeknél23. Az onaszemnogén abeparvovek engedélyeztetéséhez vezető klinikai vizsgálatokat a 4. táblázat foglalja össze23.
4. táblázat. Az onaszemnogén abeparvovek engedélyeztetéséhez vezető klinikai vizsgálatok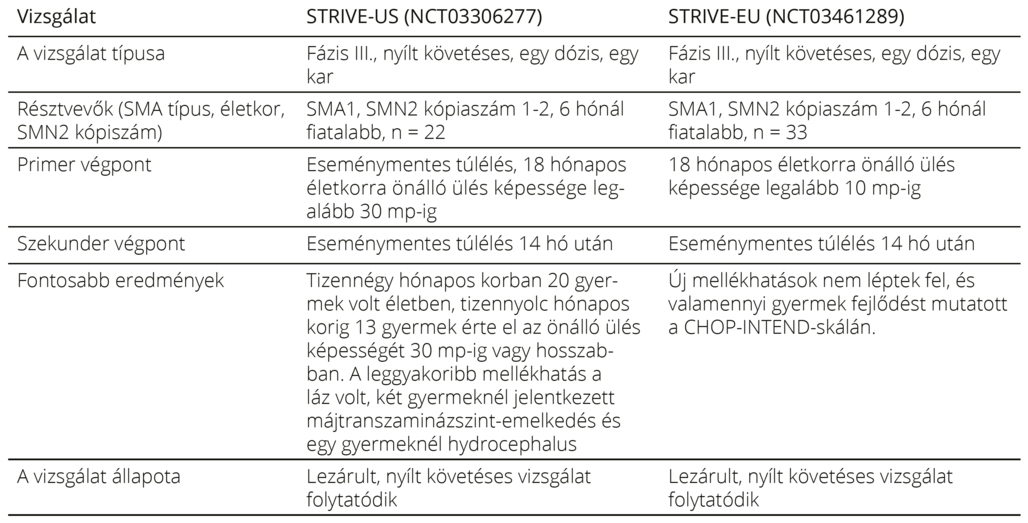
Lehetséges mellékhatások A génterápa minden esetben alapos előkészítést igényel. Csak akkor alkalmazható, ha az AAV9-ellenes antitest titere nem magas. Továbbá szteroid-előkezelést igényel, és a génterápiás beavatkozást követően legalább két hónapig a kezelő centrum közelében kell tartózkodnia a betegnek, annak érdekében, hogy ha az immunogenitás miatt akut beavatkozásra lenne szükség, az azonnal megtörténhessen. A kezelést követően májenzimszintemelkedés, thrombocytopenia, myocarditis, ritkán thromboticus microangiopathia jelentkezhet a celluláris és humorális immunválasz következtében37. Ezek kivédésére szteroidkezelést alkalmazunk, a kezelés hossza és dózisa betegre szabottan határozandó meg. Egy jól működő és megfelelő körültekintéssel dolgozó kezelő centrum a fenti mellékhatásokat jól tudja kezelni, amen nyiben a szülők compliance-e is megfelelő. Ezért nagyon fontos a génterápiás beavatkozás előtt több alkalommal hosszasan egyeztetni a családdal, hogy milyen szövődmények várhatók, és hogy a kezelés után milyen orvosbeteg kapcsolat az ideális. Egy német „real-world” adatot feldolgozó közlemény ajánlása szerint is a génterápiás készítmény hatékony 24 hónap alatti gyermekeknél, azonban a mellékhatások magas aránya miatt szorosan követni kell a kezelt gyermekek állapotát38.
Biztonságossági aggályok
Az oneszemnogén abeparvovek klinikai vizsgálatokban hatékonynak bizonyult az SMA súlyos formáiban, tünetes gyermekeknél és tünetmentes újszülötteknél is, emiatt ez egy értékes kezelési opció. A génterápiás beavatkozás nagyon új eljárás, és jelen formájában elsősorban csecsemők számára ideális, mivel az életkor előrehaladtával csökken a vírus transzfekciós hatékonysága, illetve a ma gasabb testúly magasabb vírusvektordózist tesz szükségessé, ami a készítmény immunogenitását növeli2.
A készítmény alkalmazása során néhány esetben történt immunogenitás miatt kialakuló májelégtelenségre és thromboticus microangiopathiára visszavezethető haláleset35. Ezen incidensek ellenére a génterápia megfelelő tudással és tapasztalattal rendelkező kezelő centrumban biztonságosnak tekinthető, hiszen eddig több mint 2000 esetben történt meg ez a típusú kezelés fatális kimenetel nélkül. Mindenesetre a súlyos mellékhatások megelőzésére Németországban „Rote Hand Brief”-et adtak ki, az USA-ban pedig „black box warning” került az onaszemnogén abeparvovek betegtájékoztatójába.
A fentiek alapján vetődik föl a kérdés, hogy egy génterápiás beavatkozást követően vajon van-e létjogosultsága az SMN2-expressziót fokozó terápiák alkalmazásának, mert a génterápia már önmagában megemeli az SMN fehérje mennyiségét. Ehhez képest is rendszeresen tovább emelni a fehérjeszintet az SMN2 gén aktiválásával jelenleg még előre nem látható negatív következményekkel is járhat. Arra a kérdésre, hogy a génterápia nem ideális hatását követően van-e haszna a másik két, SMN-szintet növelő kezelésnek, jelenleg a RESPOND vizsgálat keres választ, ugyanis a korábban génterápiában részesült gyermekek nuszinerszenkezelésének hatásosságát vizsgálja.
Szisztémás szövetekre gyakorolt hatás
A génterápiás készítmény szisztémásan, azonban nem egyenletesen oszlik el a szervezetben. Posztmortem vizsgálatokban a transzgén expressziója 1,49–2,65 vektorgenom/gazdasejt volt gerincvelői motorneuronokban, 1,1– 3,3 vektorgenom/gazdasejt különböző izomszövetekben, és 399,25 vektorgenom/gazdasejt a májban39. Az erőteljes dúsulás a májban potenciálisan növeli a neoplázia esélyét40. A szisztémás kezelés ellenére is, szimptómásan megkezdett kezelésnél maradnak szisztémás tünetek, így légzéstámogatást és gasztrosztómiát is igényelhetnek a kezelt gyermekek12.
Nyitott kérdés, hogy az SMN1-et expresszáló sejtekben mennyire hosszú a bevitt transzgén élettartama, valóban kitart-e egy életen át. Az is kérdéses, hogy az esetleges túlexpresszió nem okoz-e mellékhatásokat41. Jól ismert, hogy az SMN túlzott kifejeződése (például olyan egyéneknél, akiknél az SMN2 gén génkonverzió révén SMN1-gyé alakul, és így 3-4 SMN1 kópiájuk van) toxikus lehet a motoneuronokra42, és ez nemcsak a központi idegrendszerben, de a szisztémás szövetekben is okozhat problémát. Az SMA egyik egérmodelljében az AAV-vektorral bevitt SMN1 rövid távon a motoros funkciók javulásához, a fenotípus megmentéséhez vezetett, azonban később a proprioceptív neuronok pusztulásához és funkcióvesztéshez. Szintén egereken végzett kísérlet adatai alapján intravénásan, illetve közvetlenül a központi idegrendszerbe juttatva más-más mechanizmussal mentette meg a kezelt állatok fenotípusát a génterápiás készítmény43.
EMA-törzskönyv és hazai hozzáférés
Hazánkan 2022 novemberéig 34 beteg részesült onaszemnogén abeparvovekkezelésben, közülük számos külföldi állampolgár. A kezdeti hazai tapasztalatokról két magyar nyelvű cikkben számoltak be a génterápiás munkacsoport tagjai44, 45. Az első publikáció az első három, génterápiával kezelt gyermekkel kapcsolatos tapasztalatokról számol be45. Mindhárom gyermek nuszinerszenterápiában részesült a génterápiát megelőzően. A nuszinerszenkezelés és a komplex gondozás segítségével mozgásfejlődésük elindult. A génterápiás készítményt tehát nem a betegség korai stádiumában kapták meg, valamennyi beteg életkora közelítette a USA-törzskönyv által meghatározott maximális kétéves kort. Mindhárom gyermeknél tapasztaltak átmeneti thrombocytopeniát, a májenzim- és a troponinszint emelkedését. Egy gyermeknél elhúzódó szteroidkezelés volt szükséges, de mindhárom gyermek állapota rendeződött, mozgásfejlődésük az egyéves követés után egyértelműen pozitív volt. 2023. februárig összesen hét gyermek részesült génterápia-kezelésben a Semmelweis Egyetem I. Számú Gyermekklinikáján (Szabó Léna szóbeli közlése), és 27 (köztük 13 külföldi) gyermek (3 hó – 34 hó életkor) a Bethesda Gyermekkórházban (Mikos Borbála szóbeli közlése). 2023. év elején az újszülöttkori szűrőprogramban kiszűrt első tünetmentes baba kezelése is megtörtént már egy hónapos kora előtt (Molnár Mária Judit személyes közlése).
Riszdiplám (Evrysdi)
Molekuláris mechanizmus és kezelési protokoll
A riszdiplám az első szájon át szedhető SMA betegségmódosító terápia, egy kismolekula, ami a nuszinerszenhez hasonlóan az SMN2 pre-mRNS splicing mechanizmusának módosítása révén növeli a normálhosszúságú SMN-fehérje szintjét46. A riszdiplám két helyen köt az SMN2 pre-mRNS 7-es exonjához: az ESE2 régióhoz és az 5’ splice helyhez (5’ss). Az 5’ss-hez kötődés az U1 snRNS (ez a kis RNS-molekula a spliceosoma-komplex része) kötődését fokozza, míg az ESE2-höz való kötés a hnRNP G (heterogeneous nuclear ribonucleoprotein G) diszlokációjához vezet, ami az U1 snRNP- (U1 small nuclear ribonucleoprotein) komplex kötődését teszi lehetővé. Mindezek a változások a 7-es exon inklúziójához és normálhosszúságú SMN2 mRNS (és ezáltal SMN fehérje) termelődéséhez vezetnek. A riszdiplám napi rendszerességgel szedendő, dózisa testsúly- és életkorfüggő: 0,2 mg/ttkg két hónap és két év között, két év feletti és 20 kg-nál kisebb súlyú betegek részére 0,25 mg/ttkg, 20 kg testsúly felett pedig – az off-target hatások mérséklésére – egységesen 5 mg. A riszdiplám a kezelés megkezdését követően 7–14 nap alatt éri el a steady-state plazmakoncentrációt. Elsősorban flavin monooxigenázokon és P450 citokrómokon keresztül metabolizálódik47.
Klinikai vizsgálatok
A riszdiplám hatásosságát és biztonságosságát a FIREFISH, SUNFISH, RAINBOWFISH (NCT03779334) és JEWELFISH (NCT03032172) tanulmányok vizsgálják23. A gyógyszer engedélyezéséhez a FIREFISH és SUNFISH adatait használták. A FIREFISH és a SUNFISH vizsgálatok alanyai szimptómás SMA-s egyének. A JEWELFISH olyan 6 hónaposnál idősebb SMA-s egyéneket vizsgál, akik már részesültek valamilyen terápiában, a RAINBOWFISH pedig a preszimptómás, hat hetesnél fiatalabb, SMA genetikai diagnózissal rendelkező csecsemők kezelése során gyűjtött tapasztalatokat elemzi.
Az egyéb SMA betegségmódosító kezeléseket követő riszdiplámhatást elemző JEWELFISH (173 fő) vizsgálatban 12 hónap után a résztvevők állapota stabil volt. A preszimptómás újszülötteket vizsgáló RAINBOWFISH vizsgálat még folyamatban van, köztes elemzés szerint öt kisgyermek töltött legalább 12 hónapot a kezelésen, közülük négyen érték el a maximális HINE-2 pontszámot (26 pont), egyikük két SMN2 kópiás. Az ötödik (két SMN2 kópiás) gyermek 23 pontot ért el, és segítséggel állni képes. Közel maximum CHOP-INTEND-pontszámot értek el (>60 [n = 4], 58 [n = 1]), és mindegyikük szájon át táplálkozik48. A riszdiplám engedélyeztetéséhez vezető klinikai vizsgálatokat az 5. táblázat foglalja össze23.
5. táblázat. A riszdiplám engedélyeztetéséhez vezető klinikai vizsgálatok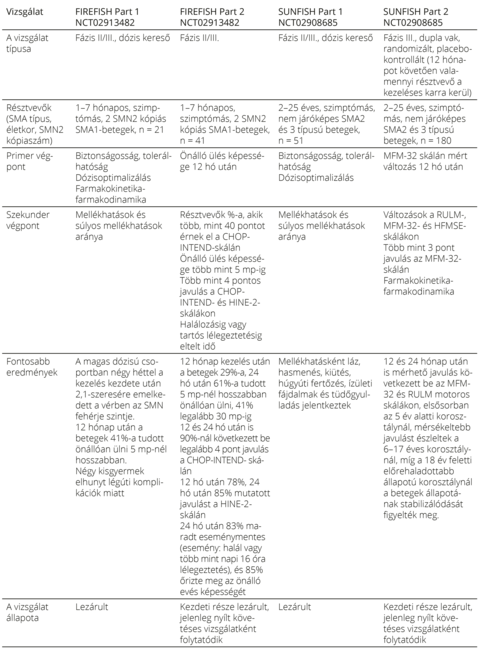
„Real-world” adatok
Az első rövid távú követési idővel rendelkező korai hozzáférésprogramból származó „real-world” adatokat nemrégiben publikálták. Az eddigi eredmények alapján a kezelőorvosok úgy találják, hogy a riszdiplám értékes kezelési opció azon betegek számára, akiknél sem a génterápia, sem a nuszinerszen kezelés risk/benefit aránya nem volt ideális, vagy akiknél a nuszinerszenkezelés nem volt hatásos49.
Lehetséges mellékhatások
A riszdiplám klinikai vizsgálatokban megfigyelt gyakoribb (esetek 10%-a) mellékhatása a láz, hasmenés és kiütések, kevésbé gyakori a szájnyálkahártya-ulceráció, a húgyúti fertőzés és az ízületi fájdalom. Az 1-es típusú betegeknél pneumoniát is megfigyeltek a vizsgálatok alatt. A riszdiplám a klinikai vizsgálatok során nem okozott olyan súlyos mellékhatásokat, amelyek a kezelés megszakításához vezettek volna47.
Biztonságossági aggályok
Hosszú távon óvatosságra inti a kezelőorvosokat az a tény, hogy a molekula az SMN2 alternatív splicingja mellett néhány egyéb gén alternatív splicingját is befolyásolja, például sejtciklus-szabályozókét, amilyen a forkhead box protein M1 (FOXM1) és a MAP Kinase Activating Death Domain (MADD). Karcinogenitási tanulmányok jelenleg folynak. A riszdiplám a MATE- (multidrug and toxin extrusion) szubsztrát gyógyszerekkel interakcióba léphet. Ez azért lényeges, mert nem ritka az SMAbetegek között például a metformin és a famotidin (amik MATE-szubsztrátok) szedése. MATE-szubsztrát szedése esetén annak dózisa módosítandó47.
Szisztémás szövetekre gyakorolt hatás
A riszdiplám átjut a vér-agy gáton, így eloszlik a periférián és a központi idegrendszerben, ami jó hatással lehet a légzési és bulbaris funkcióra, valamint a perifériás szervek állapotára. Poirier és munkatársai50 egyértelműen igazolni tudták a perifériás szervekben a fokozott SMN-expressziót. Ennek a periférás tünetekre gyakorolt hatásáról a jelenleg futó „real-world” adatok elemzése számol majd be.
EMA-törzskönyv és hazai hozzáférés
Az EMA 2 hónapos életkor fölött valamennyi SMAtípusban korlátozás nélkül engedélyezte a gyógyszert47. Hazánkban koraihozzáférés program „early access program” keretein belül 34 beteget (2023. februári állapot), NEAK-finanszírozással egy beteget kezelnek a gyógyszerrel (Molnár MJ szóbeli közlése). A hazai kezelések „real word” eredményeiről a Magyar Klinikai Neurogenetikai Társaság 2022. évi konferenciáján hallhattunk.
Összehasonlítható-e a három SMN-t célzó terápia a klinikai vizsgálatok és a „real-world” adatok alapján?
Egy nemrég megjelent metaanalízisben arra keresték a választ, hogy az eddig megjelent tudományos cikkek alapján milyen az egyes terápiák hatásossága egymással összehasonlítva51. Elemzésük nem tartalmazott adatot a riszdiplámról, mert nem találtak olyan közép- és hosszú távú „real-world” közleményt, ami az általuk megszabott kritériumoknak megfelelt volna. Megállapították, hogy az általuk elemzett mindkét terápia, azaz a nuszinerszen és az oneszemnogén abeparvovek, illetve ezek kombinációja az 1-es típusú SMA-betegek motoros fejlődését eredményezte. A pulmonológiai, gasztroenterológiai és életminőségi paraméterek nagyon hiányosan voltak fel tüntetve a közleményekben. A szerzők arra jutottak, hogy a tanulmányok sokfélesége és a sok hiányzó adat miatt nem lehet összehasonlítani a terápiákat, annyi azonban bizonyos, hogy a betegség természetes lefolyásához képest igen eltérő, biztató eredményt nyújt mindkét elemzett kezelés51.
Más összehasonlító tanulmányok a klinikai vizsgálatok eredményeit próbálták összehasonlitani az eseménymentesség, a túlélés és a motoros funkciójavulás vonatkozásában. Azonban mivel a vizsgálatokba bevont egyének jellegzetességei és az elsődleges végpontok nem voltak teljesen átfedőek, nem lehet biztonságos következtetéseket levonni ezekből az összehasonlításokból52, 53.
A 6. táblázatban a nuszinerszen és az onaszemnogén abeparvovek preszimptómás gyermekeken végzett klinikai vizsgálatait összegeztük olyan paraméterek alapján, melyeket mindkét készítmény használata során mértek23. A táblázat adatai jól szemléltetik a két készítmény segítségével elért igen hasonló eredményeket.
6. táblázat. A NURTURE (NCT02386553) és a SPR1NT (NCT03505099) tanulmányok összehasonlítása táblázatosan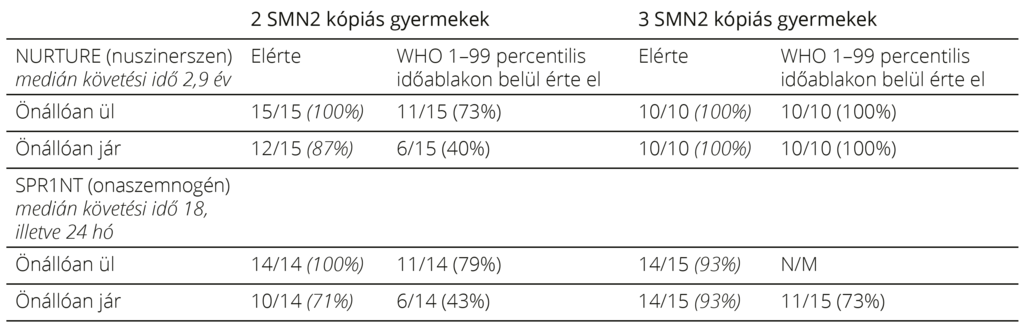
Az eddig rendelkezésre álló adatok alapján azt lehet állítani, hogy mindhárom SMN-t célzó terápia hatékony, és nem lehet egyértelmű „rangsorrendet” felállítani a hatékonyságukban. Ehelyett minden betegnél egyénileg kell mérlegelni, hogy az életkora, betegségstádiuma, várható prognózisa, preferenciái és a kezelő központ lehetőségei, tapasztalatai alapján melyik a legalkalmasabb gyógyszer az adott esetben (7. és 8. táblázat)54. Az bizonyos, hogy a preszimptómás vagy a nagyon korai stádiumban való kezeléssel érhető el a legmagasabb terápiás siker. Ezért a jelenlegi ajánlás szerint fontosabb az, hogy az adott beteg a lehető leghamarabb megkezdje a terápiát, mint az, hogy pontosan melyik terápiát választja55.
7. táblázat. A három SMN-t célzó terápia jellemzői, előnyei, korlátai 20, 35, 47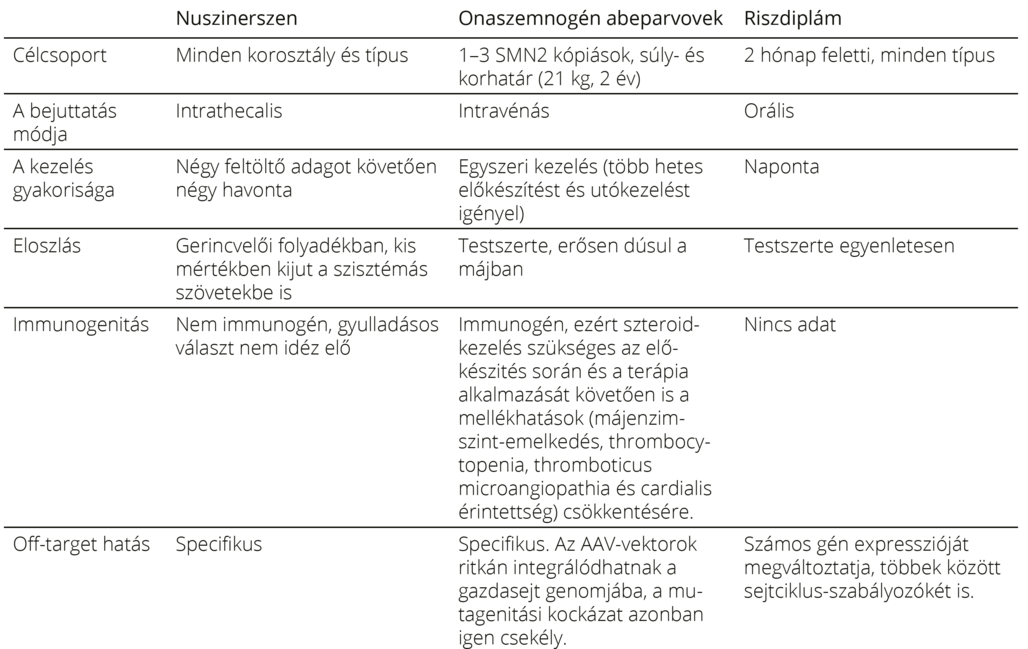
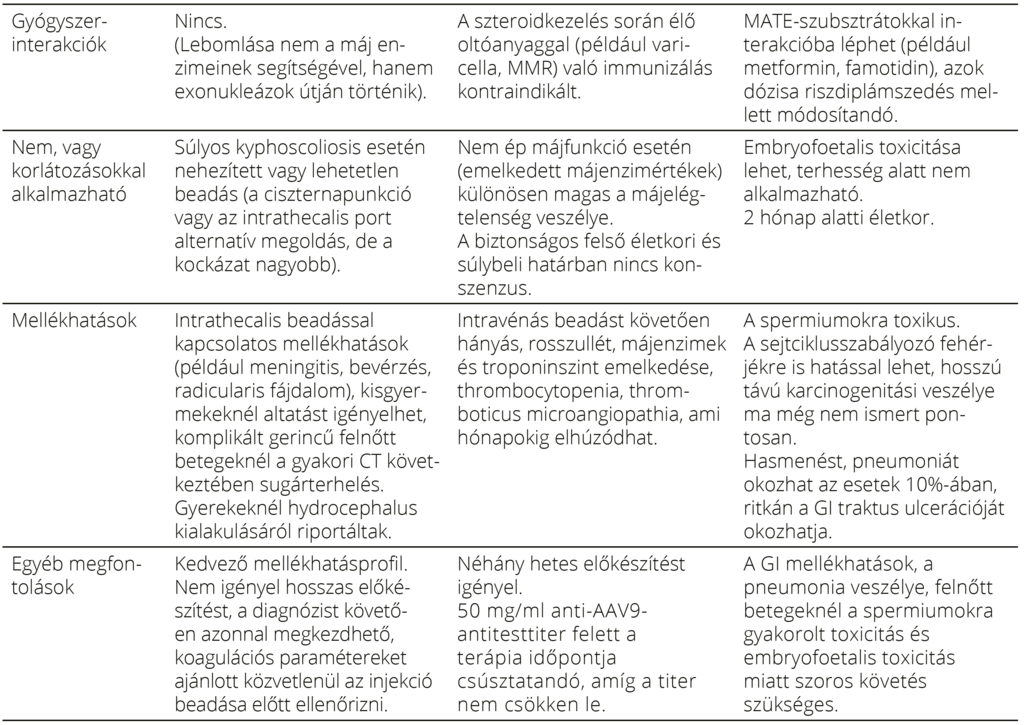
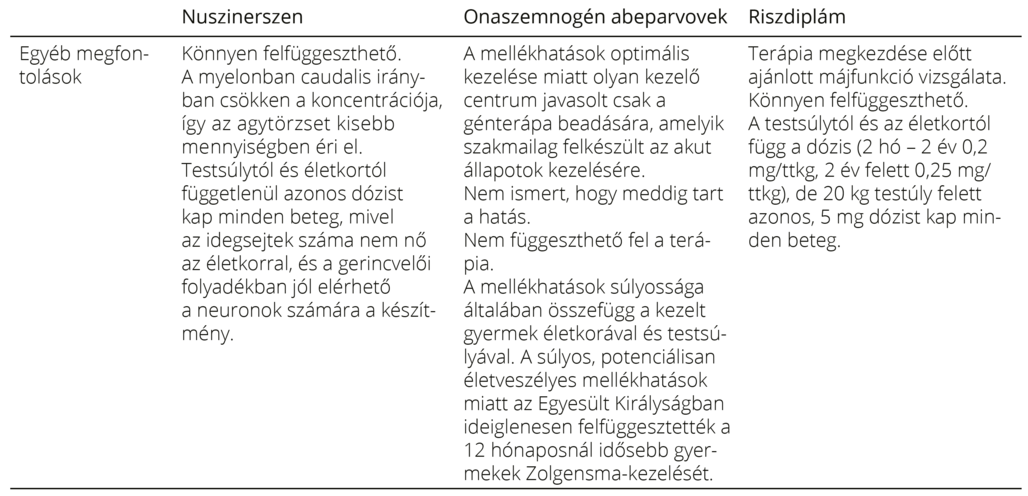
Kiemelten fontos a kezelt SMA-val élő egyének hosszú távú nyomonkövetése és standardizált adatok gyűjtése, mivel csak így lehet megválaszolni a jövőben olyan nyitott kérdéseket, mint például hogy mennyire tartós a betegek állapotának és a megszerzett motoros képességeknek a stabilizálása, várható-e hosszú távon is fejlődés stb.51. A „real-world” adatok folyamatos nyomon követésében kiemelt szerepe van a betegregisztereknek. Ilyen például a SMArtCARE platform56, aminek segítségével Németországban, Ausztriában és Svájcban gyűjtik a betegadatokat. Célja, hogy általa jobban megértsék a betegség lefolyását a terápiák mellett, illetve, hogy az adatok alapján folyamatosan módosítani, javítani lehessen a gondozási irányelveket. Minden ország saját maga is gyűjti a kezelés során megfigyelt kinikai állapotleírókat, laboratóriumi adatokat. Sajnos a nagyon súlyosan mozgáskorlátozott betegek állapotának követésére nem áll rendelkezésre objektíven monitorozható jellemző, és nincsen olyan validált kérdőív sem, ami a betegek által riportált éleminőség-változókat tudná követni.
8. táblázat. Terápiaspecifikus gondozási feladatok a terápia megkezdése előtt és során20, 35, 47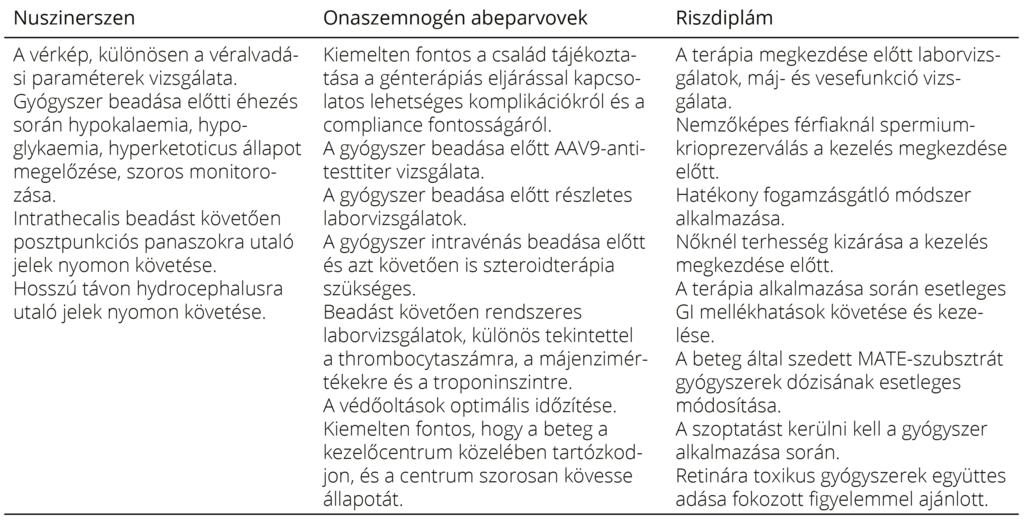
Összefoglalva elmondható, hogy körültekintően alkalmazva mindhárom terápia hatásos. Biztonságossági profiljuk eltér, a hosszú távú biztonságosságról még nem lehet egyértelmű véleményt alkotni egyik terápia esetében sem. Mindhárom terápia akkor a leghatásosabb, ha tünetmentes állapotban vagy nagyon korai stádiumban alkalmazzák. Ha csecsemők esetében génterápia mellett dönt a kezelőorvos és a család, és a kezelés a magas AAVantitesttiter vagy a gyermek állapota miatt nem kezdhető el azonnal, akkor a génterápiás kezelés megkezdéséig áthidaló terápia indítandó (két hónaposnál fiatalabb csecsemők esetében ez csak a nuszinerszen lehet).
2023 februári állapot szerint a legtöbb SMA-beteg (n = 109) nuszinerszenkezelést kap Magyarországon, emelkedik a száma a később törzskönyvezett génterápiával kezelt betegeknek is (n = 34). A 2021-ben törzskönyvezett riszdiplámot koraihozzáférés-programban kapja 34, közfinanszírozottan egy kis beteg.
A komplex gondozás és a személyre szabott orvoslás fontossága és lehetőségei
A megfelelő terápia megválasztásán túl is kiemelt cél minden egyes érintettet egyénileg, testreszabottan kezelni, gondozni. Ennek alapeleme a komplex gondozás34, 57–60 (9. táblázat). Kiemelten fontos felhívni a figyelmet arra, hogy még preszimptómásan terápiát kezdőknél is szükség van/lehet az itt felsorolt gondozási elemek egy részére a megfelelő terápiás hatás eléréséhez.
A komplex kezelés kapcsán meg kell jegyezni azt is, hogy a proaktív kiegészítő gondozás, különösen a nem invazív légzéstámogatás és a mesterséges táplálás, már az SMN-t célzó kezelések előtt is igen nagy mértékben javította az SMA-val élők prognózisát. Ahogyan ifj. John Bach, az SMA-val élők nem invazív légzéstámogatásának úttörője saját betegein meggyőzően demonstrálta61, súlyos SMA-val élők az SMN-t célzó kezelések kora előtt is megérhették a felnőttkort, sőt, egyetemi tanulmányokat is folytathattak. Bach eredményei egyben látványosan ráirányítják a figyelmünket arra, hogy megfelelő komplex kiegészítő gondozás nélkül az SMN-t célzó terápiák sem lehetnek hatékonyak. E tény szintén megnehezíti az egyes terápiák összehasonlítását, hiszen amikor egy adott betegnél jól működik egy adott terápia, az nemcsak az SMN-t célzó gyógyszer, hanem a gyógyszeres és kiegészítő gondozás együttes eredménye. Az utóbbi pedig óriási eltéréseket mutat kezelőcentrumok és egyének szintjén is.
9. táblázat. A komplex gondozás részei34, 57, 58.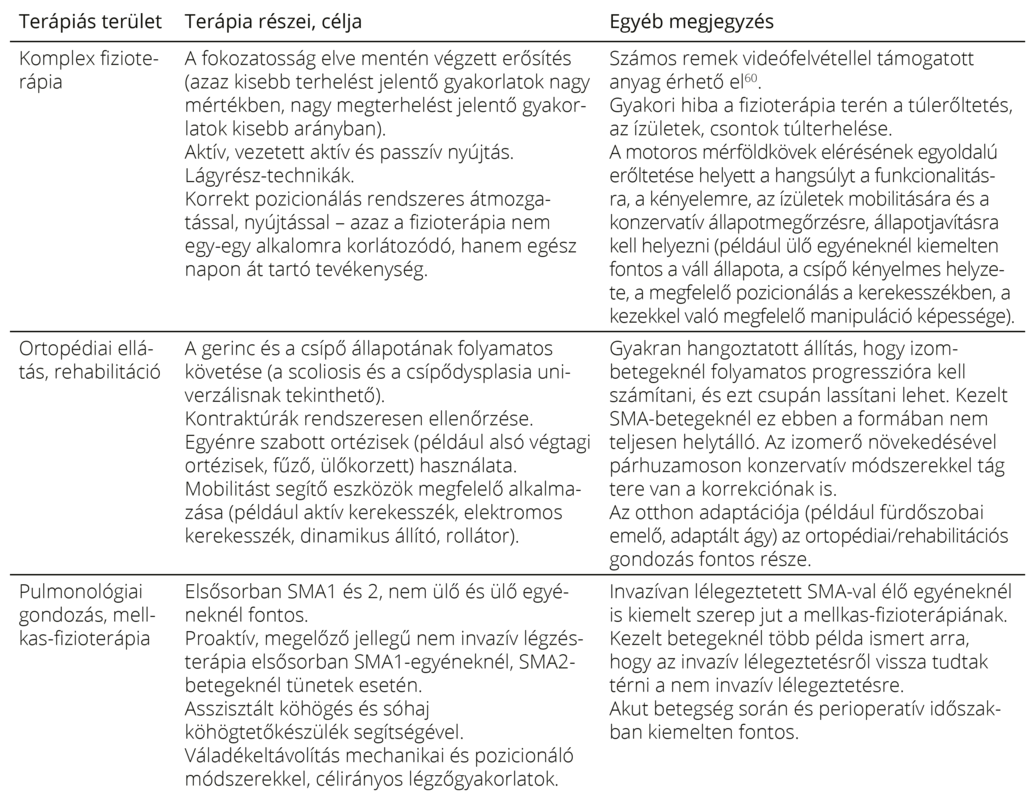


Kitekintés a jövőbe
Singh 62 arra hívja fel a figyelmet, hogy az SMA-betegség széles spektruma és a jelenleg elérhető terápiák korlátai miatt sürgős szükség van további terápiák fejlesztésére, illetve a jelenlegi terápiák tökéletesítésére. Az AAV génterápia tökéletesíthető a vektorok egy új generációjával. Az ASO technológia terén preklinikai kísérleteknek köszönhetően tudjuk, hogy még hatékonyabb és specifikusabb oligókat is ki lehet fejleszteni63, illetve a jövőben kombinálható volna egy intrathecalisan adott ASO egy kis koncentrációban, periférián adott ASO-val is. Fontos az ASO-k dózisának optimalizálása is, erre irányulnak most is klinikai vizsgálatok emelt dózisú nuszinerszennel. Fontos lenne továbbá specifikus terápiákat fejleszteni, illetve reallokálni célzott szervi funkciók javítására, mint például a gastrointestinalis rendszer, máj, tüdő, vese működése, illetve a neuroinflammáció mérséklése. Ezért kiemelten fontos továbbra is az alapkutatás, a jelenlegi terápiás megközelítések továbbfejlesztése. Nyitottnak kell lenni a kombinációs terápiákra és a terápiaváltásra is. Azaz nem zárható ki, hogy a korábban génterápiában részesült betegnek nuszinerszen- vagy riszdiplámterápiára lesz szüksége, hogy oda-vissza váltások lesznek a nuszinerszen és a riszdiplám között. A nem SMN-t célzó gyógyszerek (mint például a myostatin-inhibitorok, NMJ-t célzó gyógyszerek) pedig nagy valószínűséggel fontos szerepet fognak kapni a közeljövőben az SMN-t célzó terápiák kiegészítéseképpen az SMA-terápiás palettán59. Ilyen klinikai vizsgálat – a MANATEE – is van folyamatban a riszdiplám és a GYM32 (myostatininhibitor) kombinációja felhasználásával járóképes SMA-gyermekek számára (NCT05115110)23. Egy másik szelektív myostatininhibitor, az apitegromab és a nuszinerszen vagy a riszdiplám kombinációját vizsgálja a SAPPHIRE vizsgálat (NCT05156320)23.
Ideggyógyászati Szemle
A WHO szakértői 1986-ban fogalmazták meg a daganatos fájdalomcsillapítás alapelveit, amelynek lényege a kombinált gyógyszeres fájdalomcsillapítás, mert ez mindenütt kivitelezhető. Gyógyszeres fájdalomcsillapításra javasolt: minor analgetikum, gyenge opioid, erős opioid, és minden esetben úgynevezett adjuváns analgetikum. Kínzó daganatos fájdalom esetén azonnal erős opioid analgetikumot kell rendelni, nem szabad szenvedni hagyni a betegeket a gyengébb szerek kombinációjával.
Ideggyógyászati Szemle
Stroke-ot elszenvedett, majd kórházi fekvőbeteg-ellátásban, elsőbbségi rehabilitációban részesült betegek rehabilitációs eredményének vizsgálata, különös tekintettel a funkcionális állapotban bekövetkező változásokra.
Ideggyógyászati Szemle
[Annak elemzése, hogy men - nyire hasznos a nervus medianus (MN) és a nervus ulnaris (UN) paramétereinek összehasonlítása distalis szimmetrikus szenzomotoros polyneuropathiában (DSMPNP) szenvedő diabeteses betegek carpalis alagút szindrómájának (CTS) diagnosztizálásában.]
Ideggyógyászati Szemle
[A metanol színtelen és erősen mérgező folyadék, ami szagában és ízében az etanolhoz hasonló. A metanol bevitele súlyos metabolikus acidózishoz, látásvesztéshez, maradandó neurológiai károsodáshoz és halálhoz vezethet.]
Ideggyógyászati Szemle
[Mind a carotisstent (CAS), mind a carotisendarterectomia (CEA) alkalmazható a carotisszűkület által okozott ischaemiás stroke megelőzésére, de mindkét beavatkozás komplikációkkal járhat. Célunk annak megállapítása, melyik carotis-ultrahang-módszer a legalkalmasabb a beavatkozáshoz kapcsolódó szövődmények előrejelzésére (embolisatio, új neurológiai tünetek).]
Lege Artis Medicinae
A spinalis izomatrophia (SMA) autoszomális recesszív módon öröklődő, progresszív neuromuscularis kórkép, amely súlyos proximalis izomgyengeséghez és izomsorvadáshoz vezet. Klinikailag az SMA a korai megjelenésű súlyostól a felnőttkori, lassan progrediáló formáig változatos megjelenésű betegségek csoportját öleli fel. Az enyhe és felnőttkori formákat ritkán ismerik fel. Az SMA genetikai hátterének megismerését követően, az elmúlt években egyre több betegségmódosító kezelési lehetőség vált elérhetővé, amelyek megváltoztatják az SMA természetes lefolyását. Így a betegségmódosító kezelések bevezetésével szükségszerűvé vált az eddig alkalmazott multidiszciplináris palliatív ellátás mellett az új irányelvek megalkotása. A betegség káros hatásainak és a specifikus terápiák hatékonyságának a becslése szempontjából nagyon fontos a motoros funkciók változásainak utánkövetésével együtt az egészséggel kapcsolatos életminőség vizsgálata is.
Ideggyógyászati Szemle Proceedings
A molekuláris biológiai technológiáknak köszönhetően az elmúlt években számos neurogenetikai betegség patofiziológiájának és genetikai hátterének megértésében igen gyors előrelépésnek lehettünk a szemtanúi. Ehhez hasonló forradalmi fejlődésnek lehettünk a szemtanúi a gyógyszeriparban, különös tekintettel az árva gyógyszerek területén is. Ez a terápiás forradalom nem várt reményeket váltott valóra a neurogenetikai betegségekben szenvedők és kezelő orvosaik számára is. Ma már a gyógyszerpiac igen jelentős részét teszik ki az árva gyógyszerek.
Magyar Immunológia
A génterápiát eredetileg elsõdlegesen olyan betegek kezelésére fejlesztették ki, akiknek valamilyen géndefektusuk van, és a hiányzó gént pótolják ezzel az eljárással. Késõbb az indikációs kört géntranszfer formájában kiterjesztették, ami bizonyos betegségek kezelésére alkalmas gének bevitelét jelenti. Ez utóbbi eljárás bevezetésre került rheumatoid arthritisben is, ahol a génterápiának számos elõnye lehet más eljárásokkal szemben.
Ideggyógyászati Szemle Proceedings
Bevezetés: Az elmúlt időszakban számos tanulmány látott napvilágot, ami a Huntington-kórban szenvedő betegek, illetve a tünetmentes hordozók kezelését tűzi ki célul, ugyanakkor a felmerülő nehézségekből adódóan áttörő terápiás eredményt egyelőre nem sikerült elérni. Az eredményes terápia egyik alapfeltétele a betegpopuláció klinikai és genetikai epidemiológiai jellemzőinek mélyreható ismerete. Módszerek: A Szegedi Tudományegyetem Neurológiai Klinikáján Huntington-kórral diagnosztizált betegek fenti jellemzőit két folytatólagos tanulmány keretében vizsgáltuk. Az első, 1999-ben megjelent, magyarországi populációs genetikai jellemzőket először publikáló vizsgálatban ugyan számos paraméter (például CAG-ismétlődés hosszeloszlása, az expandált allél szülői eredetének vizsgálata, anticipáció kérdésköre, preszimptómás esetek frekvenciája) már tanulmányozásra került, ugyanakkor például az intermedier allélok kérdéskörével kevésbé foglalkozott. A második tanulmányunkba – melynek során a rendelkezésre álló elektronikus orvosi adatbázisokban folytattunk keresést a Betegségek Nemzetközi Osztályozásában (BNO) szereplő G10H0 kódra az 1998. január 1. és 2018. december 31. közötti időszakban, továbbá áttekintettük az erre a periódusra vonatkozó, papír alapú járóbeteg-dokumentációt – 90 Huntington-kóros beteget (45 férfi és 45 nő), valamint 34 tünetmentes hordozót (15 férfi és 19 nő) tudtunk bevonni. Eredmények: A medián életkor a tünetek megjelenésekor 45 év volt (16–79 év). Fiatalkori (juvenilis) betegségkezdetet 3 esetben (3,3%), míg késői betegségkezdetet 7 esetben (7,8%) találtunk. A medián CAG-ismétlődésszám a patológiás allélok vonatkozásában 43 (36–70), míg a nem patológiás allélok esetében 19 (9–35) volt. A patológiás allélok 17,5%-a a csökkent penetranciájú, míg a nem patológiás allélok 7%-a az intermedier tartományba esett. Következtetés: A két tanulmányban vizsgált populáció jellemzőiben nem találtunk számottevő különbséget, és azok megfelelnek a rendelkezésre álló nemzetközi szakirodalomban szereplő adatoknak is. Kivétel ez alól a csökkent penetranciájú, illetve intermedier tartományba eső allélok magasabb aránya. Ennek különös jelentőségét az adja, hogy ezen alpopulációk alkalmasak leginkább azon faktorok tanulmányozására, melyek a betegség manifesztációját meghatározzák, ezáltal jövőbeli eredményes terápiás próbálkozások alapjait képezhetik.
Ideggyógyászati Szemle
Az ischaemiás stroke a kognitív és a motoros funkciók súlyos károsodását okozza, ráadásul az egyik leggyakoribb halálozási ok. Hatékony farmakoterápia hiányában a génterápia jelenthet megoldást a neuroprotekcióra stroke esetén.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.