Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 459
A daganatos elváltozások hatékony diagnosztikáját segítő labort alakítottak ki Szegeden
A daganatos elváltozások hatékony diagnosztikáját segítő laboratóriumot alakítottak ki uniós támogatással a Szegedi Tudományegyetem (SZTE) patológiai intézetében – tájékoztatta a felsőoktatási intézmény közkapcsolati igazgatósága az MTI-t.
Negatívnyomás-terápia Covid-19-pandémia idején: fasciitis necrotisans és retroperitonealis tályog kezelése
A fasciitis necrotisans ritka, nagy mortalitású betegség. Leggyakrabban a végtagokon, hasfali lágyrészekben és a perinealis régióban alakul ki, de ritkán a retroperitoneumot is érintheti. A kezelés alapja a korai necrectomia és antibiotikum-kezelés, melyet negatívnyomás-terápiával érdemes kiegészíteni. Közleményünkben egy kiterjedt, csípőtájékról kiinduló fasciitis necrotisans és a retroperitoneumba terjedő tályog sikeres kezelését ismertetjük. A beteg jobb csípőtájéka fölött fokozatosan növekvő, fájdalmas duzzanat alakult ki, amely kifekélyesedett. Első vizsgálatakor jelentősen emelkedett laboratóriumi gyulladásos markerek igazolódtak, emellett a necroticus elváltozás hátterében felmerült a sarcoma lehetősége. Kezdetben antibiotikum-kezelés és mintavétel történt. A CT-vizsgálat nagy méretű, a retroperitoneumba is terjedő tályogrendszert igazolt. A műtét során fasciitis necrotisansra jellemző kép volt látható, necrectomia, sebtisztítás történt, melyet negatívnyomás-terápiával egészítettünk ki. A beteg 14 napi kezelést követően gyógyult. A fasciitis necrotisans kezelésében alapvető fontosságú a negatívnyomás-terápia. A kezeléssel jelentősen csökkenthető a sebkötözések, valamint az egészségügyi személyzet és betegek közötti kontaktusok száma. A Covid-19-járvány miatt ennek különös a jelentősége, hiszen a vírus terjedésének féken tartásában kiemelt szerepe van az emberek közötti szoros kontaktus minimalizálásának.
Jövő Unikornisa Díj a rákdiagnosztikát segítő fejlesztésért
A Digital Europe kereskedelmi szövetség ebben az évben a Peták István és Schwab Richárd kutatóorvosok által alapított Oncompass Medicine molekuláris diagnosztikával és precíziós orvoslással foglalkozó céget díjazta a Jövő Unikornisa Díjával. A kitüntetést azon technológiai vállalkozásoknak adományozzák, amelyek jövőbeli értéke meghaladhatja az egymilliárd dollárt. Az Oncompass Medicine-t 17 európai ország legkülönfélébb területeken működő vállalkozásai közül választották ki. Az elismerést Mariya Gabriel az EU innovációért felelős biztosa adta át virtuálisan a magyar biotechnológiai cégnek 2021. február 4-én, a rák világnapján. A Jövő Unikornisa Díjat a kutatóorvosok a daganatos betegek célzott terápiájának segítésére fejlesztett orvosi szoftverrel érdemelték ki. A Real-Time Oncology Treatment Calculator (TM) elnevezésű informatikai eszköz példátlanul sok, 405 ráktípusban, 52 ezer mutáció esetén, 26 838 orvosbiológiai szabály alapján, 1417 gyógyszerhatóanyag közül képes rangsorolni az adott beteg betegségéhez és genetikai profiljához kijelölhető, legjobb reményekkel kecsegtető terápiákat. Mindehhez pedig 0,02 másodpercre van szüksége. Peták István évtizedek óta foglalkozik molekuláris rákdiagnosztikával, személyre szabott precíziós onkológiával, célzott gyógyszerfejlesztéssel. A kutató a díj alkalmából adott interjút folyóiratunknak.
A ketontestek terápiás potenciálja cardiovascularis betegségben
A ketontestek cardiovascularis hatásai túlmutatnak az energetikán: vasodilatatorok, gyulladásgátló, vérnyomás- és testsúlycsökkentő hatással bírnak.
A krónikus neurológiai Covid-tünetek hátterében álló mechanizmus
Bár a hosszú Covidnak nevezett krónikus tünetegyüttes diszexekutív szindrómával vagy ködös agyműködéssel járhat, az eddigi vizsgálatok nem találtak a tünetek hátterében encephalitist. Amerikai patológusok most megfejtették a mechanizmust, ami legalábbis részben magyarázhatja a neurológiai tüneteket.
Európa összefogott a ritka betegségekkel élőkért
A kontinens döntéshozói, egészségpolitikusai, betegszervezetei, szakemberei, a digitális egészség úttörői közös platformra léptek a Biogen vállalat, a Reuters Events és az EU40 együttműködésével megrendezett virtuális konferencián, hogy kollektív tudásukkal még hatékonyabban lépjenek a ritka betegek érdekében, hogy mind a diagnózishoz, mind az ellátáshoz való hozzáférés Európa-szerte egységes legyen. Költséghatékonyságot célzó stratégiát, az ismeretek összegyűjtését és az információhoz való hozzáférés javítását, erősítését hirdették meg. Dr. Molnár Mária Judit, a Semmelweis Egyetem Genomikai Medicina és Ritka Betegségek Intézetének igazgatója értékelte az összefogás jelentőségét és mutatta be a hazai helyzetet.
A (K)RAS-mutáció molekuláris epidemiológiája emberi daganatokban
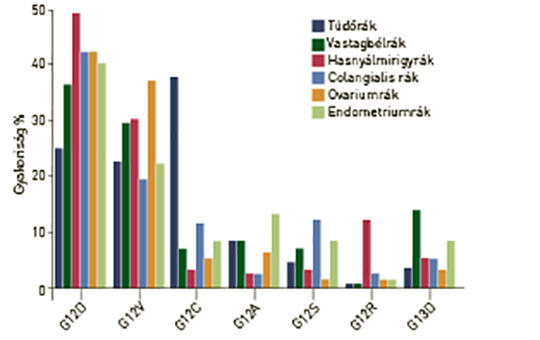
A RAS onkogén mutációja a leggyakoribb génhiba emberi daganatokban, és a három családtag közül a K-RAS-é a leggyakoribb, amit az N-RAS követ. A tipikus K-RAS-mutáns daganatok a hasnyálmirigyrák, vastagbélrák és tüdő-adenocarcinoma, amelyekben a mutáns variáns allélok gyakorisága igen heterogén, aminek hátterében eltérő karcinogenezis áll. A RAS-mutáns daganatok genetikai sokszínűségét tovább fokozza, hogy a mutáns allél homo- vagy heterozigóta formában van-e jelen. A sokszínűség egy másik forrása az, hogy a különféle daganatokban a K-RAS-mutánsok esetében sajátos kísérő mutációs mintázatú altípusok lehetnek. Mindezeknek az a következménye, hogy a K-RAS-mutáns daganatok biológiai viselkedése és nagy valószínűséggel terápiás érzékenysége is nagyon heterogén lehet. A K-RAS-inhibitorok klinikai debütálásával ezeknek a kérdéseknek egyre nagyobb jelentősége lesz.
Egészségpolitika
2021. FEBRUÁR 05.
Vége a TVK 16 éves uralmának – újraszabták a kórházi finanszírozást
A teljesítmény-volumenkorlát elve szerinti számolás tizenhét év után megszűnik a szakellátásban.Bevezetik az éves keretet a finanszírozásban, illetve szakmákra lesz kiosztva ez a pénz. Az idén életbe lépett változás megkérdezett szakértőink szerint leginkább átnevezés, de nem jelent átütő változást. Igaz, várhatóan megszűnik a kórházak mozgástere abban, hogy a jól és kevésbé jól fizetett területek között „játszanak”.
Agnosztikus terápia onkológiai alkalmazása
A tumoragnosztikus terápia az onkológiai kezelés ígéretes lehetősége, azonban a potenciális célpontok klasszifikálása, validálása, azok egységes módszerek szerinti kimutatása elengedhetetlen. A tumoragnosztikus kezelések engedélyezése új típusú, biomarker-vezérelt klinikai vizsgálatok bevezetését tette szükségessé. Jelenleg három tumoragnosztikus molekuláris célpont ismert: a daganatok magas fokú mikroszatellita-instabilitása (MSI-H), a neurotrop-tirozinkináz-receptor (NTKR) gének fúziója, valamint a daganatok magas tumormutációs terhelése (TMB-H). A pembrolizumab (anti-PD-1 antitest) az első tumoragnosztikus indikációban is törzskönyvezett gyógyszer, amelyet először MSI-H daganatok kezelésére engedélyeztek, majd később a magas TMB is bekerült az indikációk közé. Az NTKR-fúziót hordozó daganatok kezelésére a larotrectinib és az entrectinib került engedélyezésre.
A méh rosszindulatú daganatainak korszerű onkológiai kezelése
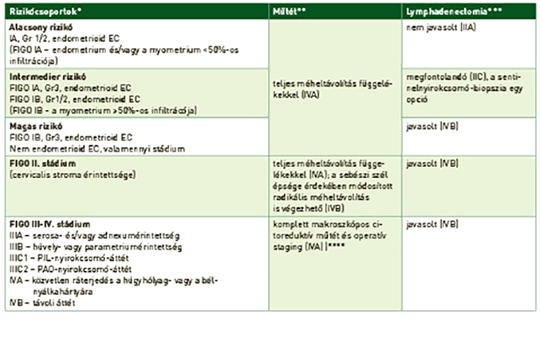
Világviszonylatban évente közel 400 000 nőnél igazolódik méhtestrák, amely 2018-ban körülbelül 90 000 nő halálát okozta. Az esetek túlnyomó részét a méhnyálkahártya hormonérzékeny hámjából kiinduló endometriumcarcinomák (EC) alkotják. A sarcomák a méhtestrákok alig 3%-át adják. Az EC-k 80-85%-a jó prognózisú, mivel alacsony gradusú és korai stádiumban kerül felismerésre, amikor a műtét és az esetleges posztoperatív kezelés révén a gyógyulás reális terápiás cél. Az előrehaladott stádiumban diagnosztizált EC és a nem endometrioid altípusok esetén a prognózis lényegesen rosszabb. A magas rizikójú EC optimális adjuváns kezelésére irányuló vizsgálatok egy része még folyamatban van, illetve a bővülő molekuláris ismeretek újabb vizsgálatokat generálnak. A méhtestsarcomák esetében is a sebészi eltávolítás jelenthet kuratív megoldást, az adjuváns kezelésre vonatkozó evidenciák bizonytalanok, egyéni mérlegelést igényelnek. A modern onkoterápia érájában már nemcsak a betegségmentes élet meghosszabbítására, hanem az élet minőségének minél teljesebb megőrzésére is törekszünk. A nőgyógyászati onkológiában ezt jelenti a fertilitás vagy a funkcionáló ováriumok lehetőség szerinti megőrzése; a magas morbiditással járó szisztémás lymphadenectomia indikációs körének szűkítése; a kedvezőbb mellékhatásprofilú brachytherapia alkalmazása a teljes kismedencei besugárzás helyett. A modern onkoterápia az úgynevezett biológiai kezelések által az előrehaladott betegségek ellátásának is a részévé vált: kemoterápia mellett/után progrediáló esetekben a pembrolizumab az EC és a sarcomák esetén is alkalmazható mikroszatellita-instabilitás vagy magas tumormutációs terheltség esetén, míg az NTRK fúziós gén jelenlétében larotrectinib vagy entrectinib mint célzott tirozinkináz-gátlók javasolhatók. Az EC-k 70-80%-át kitevő mikroszatellita-stabil esetekben (nem endometrioid altípusokban is!) a pembrolizumab lenvatinibbel kombinációban adható a kemoterápia után. Az EC területén gyarapodnak továbbá az egyéb célzott terápiás szerekkel szerzett tapasztalatok is (anti-HER2 serosus carcinomában, mTOR-gátló kezelés, endokrin terápia, más immun checkpoint inhibitorok, tirozinkináz-gátlók, PARP-gátlók és kombinációs kezelések). A jelen munka a méhtestrákok onkoterápiájáról kíván rövid összefoglalást nyújtani az aktuális szakmai ajánlások és a folyamatban lévő vizsgálatok bemutatásával.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.