Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 148
Phaeochromocytoma és paraganglioma
A phaeochromocytomák, paragangliomák a ritka neuroendokrin tumorok közé tartoznak. Ezek a daganatok katecholaminokat termelnek, jellemző tüneteik hormontermelésükkel függenek össze. Biokémiai vizsgálatok támaszthatják alá a klinikai gyanút, a katecholaminokat és bomlástermékeit vizsgáljuk. Képalkotó vizsgálatokkal, elsősorban komputertomográfiával érdemes a primer tumort lokalizálni, a betegség stádiumát felmérni. A kivizsgálás szerves része a funkcionális képalkotás, amely a metasztatikus stádiumban alkalmazható terápiás lehetőségekről is ad információt. Lokalizált esetekben a műtéttől várható gyógyulás. Metasztatikus stádiumban a terápia megválasztásának szempontjai hasonlók az egyéb neuroendokrin tumorok kezelése során alkalmazottakhoz, a progresszió gyorsasága, a tünetek megjelenése, a daganatterhelés mértéke segít a szisztémás kezelések sorrendjének megválasztásában. A szisztémás terápiás lehetőségek közé izotópkezelések, kemoterápia, célzott terápiák tartoznak.
Immunonkológia
2021. DECEMBER 26.
hirdetés
Kombinációs terápiák a vesecarcinoma első vonalas kezelésében
A metasztatikus vesedaganat első vonalas kezelése 2018-ban újabb mérföldkőhöz érkezett. Ebben az évben került bevezetésre az immunterápiás kombinációs kezelés az ipilimumab és nivolumab formájában. A következő években az immunterápia és célzott kezelések együttes alkalmazása hozott átütő sikert. Összefoglalónk célja a már Európában is törzskönyvezett kombinációs kezelések klinikai vizsgálatainak bemutatása kronológiai sorrendben, valamint bízva abban, hogy a jövőben finanszírozásra kerülnek hazánkban is ezek a kombinációk, rövid gyakorlati útmutatás arra vonatkozóan, miként döntsünk első vonalas alkalmazásuk során.
Biomarkerek szerepe a gastrointestinalis daganatok kezelésében
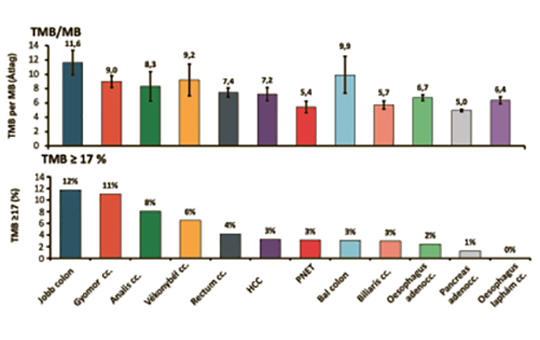
Összefoglaló – A komprehenzív molekuláris profilvizsgálatokon, a bioinformatika fejlődésén alapuló precíziós onkológiai megközelítés, célzott terápia és immunellenőrzőpont-inhibitorok (immune checkpoint inhibitors – ICI) gyökeresen változtatta meg az onkoterápia eredményeit. Az előrehaladott, metasztatikus stádiumú emésztőrendszeri daganatokban szenvedő betegek kedvezőtlen túlélési esélye jelentősen javult az új terápiás lehetőségek alkalmazásától. A sikeres terápia azonban számos molekuláris jellemző ismeretét, meghatározását igényli – PD-L1 expresszió, MSI (mikroszatellita-instabilitás)/dMMR (mismatch repair deficiency), TMB (tumor mutational burden), rezisztenciamutációk, genetikai variánsok jelenléte. Jelen összefoglaló célja áttekintést adni a gastrointestinalis (GI) traktus rosszindulatú daganatainak precíziós onkológiai szemléletű kezelésében alkalmazható prediktív és prognosztikus biomarkerek szerepéről, jelentőségéről.
A metasztázisok keletkezésének mechanizmusa és lehetséges terápiája
A daganatos progresszió végső lépése az áttétes betegség kifejlődése. A folyamat biológiai alapjai nagyrészt tisztázottak, de molekuláris háttere nem. Ebben a folyamatban a daganatsejtek maximális kollaborációs és alkalmazkodóképessége fejlődik ki az extrém környezethez és a különféle normális sejtekhez, ami miatt az áttétképzés szervspecifikus formában valósul meg. A szervi áttétek a primer tumortól is, de sajnos egymástól is különböznek, ami azt is jelenti, hogy ez a különbözőség genetikailag is fennáll. Az áttétes betegség és a progresszió hiperszenzitív monitorozása ma már lehetséges molekuláris eszközökkel. Addig is, amíg nem rendelkezünk a különféle szervi áttéttípusok kezelésére specifikusabb terápiákkal (a csontáttétekhez hasonlóan), arra kell törekedni, hogy a meglévő terápiás modalitásokat lehetőleg a metasztatikus betegség és nem a primer tumor jellemzői alapján tervezzük.
Fókuszban
2021. OKTÓBER 20.
Megoperáljuk-e a metasztatikus vesedaganatot?
Eredeti cikk: Mejean A, Ravaud A, Thezenas S, et al. Sunitinib alone or after nephrectomy in metastaticrenal-cell carcinoma. N Eng J Med 2018;379(5):417-27. https://doi.org/10.1056/NEJMoa1803675
A csont- és ásványianyagcsere-zavar kezelése
A krónikus vesebetegség következtében kialakuló csont- és ásványianyagcsere- zavar egy szisztémás betegség, amelynek az alábbiak a jellemzői: ― a fibroblastnövekedési faktor-23 (FGF 23), kalcium-, foszfát-, parathormon- (PTH-) és D-vitamin anyagcsere zavara; ― a csontátépülés, -mineralizáció, -volumen, lineális növekedés és erősség zavara, amely a renalis osteodystrophiához (ROD), valamint osteoporosishoz vezet, és fokozott törési kockázatot eredményez; ― metasztatikus vascularis és lágy rész kalcifikáció/csontosodás, amelynek következménye a jelentősen fokozott cardiovascularis morbiditás, mortalitás.
Angiogenezis-gátlók és immunjelátviteli pontokra ható szerek kombinációja egymás hatásának potencírozására
A daganatok nem sebészi kezelésében mind az angiogenezis gátlásának, mind az immunfolyamatok befolyásolásának jelentős és egyre növekvő szerepe van. A tumoros neo-angiogenezis kedvezőtlenül befolyásolja az immunrendszer működését, ezért gátlása serkenti a kulcsfontosságú T-lymphocyták és azok működését támogató egyéb tényezők hatását, kedvezően befolyásolja a daganat mikrokörnyezetét, miközben az immunjelátviteli pontokra ható kezelés segít az érrendszer normalizálásában. A két támadáspont együttes befolyásolása ezért kedvező hatású lehet. A szerzők vesesejtes rákban, melanoma malignumban, nem kissejtes tüdőrákban, vastag- és végbél-, valamint hepatocellularis és emlőrákban mutatják be a két hatásmechanizmusú csoportba tartozó szerek alkalmazását és kombinálását, megállapítva, hogy sikerrel zárult fázis III vizsgálatok döntően a világos sejtes (vagy világos sejtes komponenst is tartalmazó) vesesejtes rákokban történtek. Hangsúlyozzák, hogy az immunterápiához általában szükséges az érzékenységet előrevetítő paraméterek (megfelelő PD-L1, MSI-H, dMMR, TMB-H) kimutatása, és a tumoragnosztikus kezelés terápiás filozófiája mellett is figyelembe kell venni a törzskönyvezett javallatokat.
A humán immunrendszer rendszerelvű megközelítése
A nukleotidpolimorfizmusok kutatása révén kiderült, hogy az autoimmun betegségek kialakulásában nagyon kis hatáserősséggel nagyon sok genetikai lokusz közreműködik, és itt is kiderült, hogy egy-egy kórkép molekuláris heterogenitása – pl. SLE esetén – milyen óriási. E betegségek kezelését forradalmasította a biologikumok rendszerimmunológiának köszönhető bevezetése.
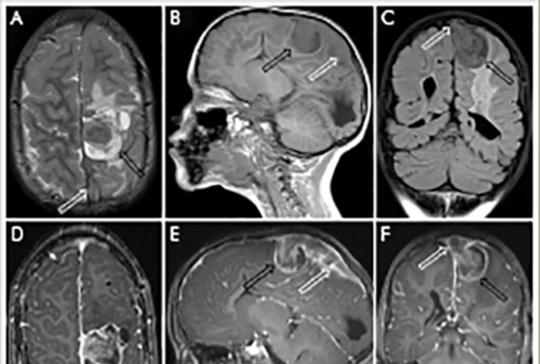
[Extraskeletalis, intraduralis, nem metasztatikus Ewing-sarcoma]
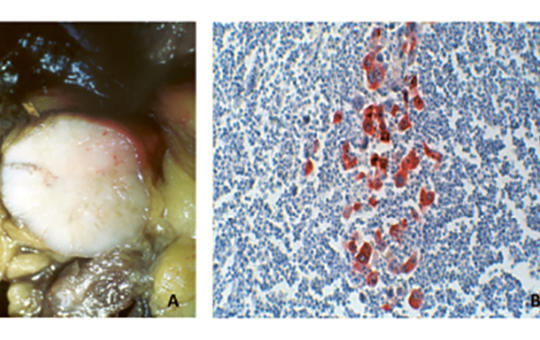
[Intracranialis lokalizációjú Ewing-sarcoma nagyon ritkán fordul elő. Egy négyéves fiúgyermek klinikai és képalkotó vizsgálatainak jellegzetességeit ismertetjük. Koraszülött volt, intraventricularis vérzés szövődményeként kialakult posthaemorrhagiás hydrocephalus miatt ventriculoperitonealis sönt beültetésen esett át újszülöttkorában. Rendszeres gondozás során nem észleltük söntvezetési zavar vagy emelkedett intracranialis nyomás tüneteit. Nyolc hónapos korában készült utolsó képalkotó vizsgálata. Négyéves korában ismétlődő hányás, fokális epilepsziás rohamok kezdődtek. Koponya-MR-vizsgálata bal oldali frontoparietalis, a sinus sagittalis superiorba betörő térfoglaló folyamatot mutatott. Craniotomia során a tumor teljes eltávolításra került. A tumorszövet hisztológiai vizsgálata igazolta a kis, kék, kerek sejtes daganatot. A Ewing-sarcoma diagnózisát az EWSR1-géntranszlokáció kimutatása FISH-módszerrel megerősítette. A staging vizsgálatokkal metasztázis nem volt kimutatható. A beteg az EuroEwing99 protokoll szerint kapta meg kezelését. 10 év telt el a diagnózis és a műtét óta, jelenleg is tumor- és rohammentes, életminősége jó.]
Daganattúlélők nőihormon-pótló kezelése – Irodalmi áttekintés
Az onkológia gyors fejlődése az onkológiai betegek mind hosszabb túléléséhez vezet. Közülük egyre többen érik el a természetes menopauzát, vagy onkoterápiájuk mellékhatásaként idő előtt tapasztalják a gonadalis funkciók megszűnését, vazomotoros tünetekkel és hosszú távú negatív cardiovascularis és csontrendszerre gyakorolt hatásokkal. Egyre növekvő számban kérnek ilyen betegek endokrinológiai segítséget hormonpótló terápia (HRT) formájában. A WHI (Women’s Health Initiative) tanulmány eredményeinek téves értelmezése irracionális félelemhez vezetett a nőihormon-pótlás tekintetében mind a betegek, mind az orvosok körében. Számos orvos számára logikus és biztonságos következtetésnek tűnik a HRT elkerülése, feltételezve, hogy ez a hozzáállás biztosan nem okoz kárt, míg az ösztrogén önmagában vagy gesztagénekkel történő alkalmazása onkológiai és thrombemboliás kockázatokat hordoz, szövődmények esetén pedig peres eljárásokhoz is vezethet. Ugyanakkor már a WHI-tanulmány eredményei előtt is ismert volt, hogy a korai menopauza és hypogonadismus a skeletalis és a cardiovascularis hatások révén évekkel csökkenti a nők várható élettartamát, és ez a negatív hatás korrelál a hypoestrogenaemiás időszak hosszával. HRT-ről való döntés esetén ezeket a pró és kontra érveket kell mérlegelni úgy, hogy a HRT onkológiai kockázatát rendkívül nehéz objektíven felbecsülni. Összefoglaló tanulmányunkban áttekintjük a témával kapcsolatos legfrissebb evidenciákat az in vitro kísérletektől a klinikai vizsgálatokig, mind nőgyógyászati, mind nem nőgyógyászati daganatok túlélőinek vonatkozásában. Ez alapján a következő csoportokat határoztuk meg: a „HRT előnyös” (például I-es típusú endometriumcarcinoma, méhnyak-adenocarcinoma, malignus hematológiai betegségek, lokális melanoma malignum, colorectalis carcinoma, hepatocellularis carcinoma); a „HRT neutrális” (például BRCA 1/2 mutációt hordozóknál tumoros megbetegedés nélkül, II-es típusú endometriumcarcinoma, méhcarcinosarcoma és adenosarcoma, egyes ovariumtumorok, méhnyak-, hüvelyi és vulvalaphámrák, prolactinoma, veserák, hasnyálmirigyrák, pajzsmirigyrák); a „HRT relatíve ellenjavallt” különféle okok miatt (például leiomyosarcoma, bizonyos petefészekrákok, agydaganatok, előrehaladott metasztatikus malignus melanoma, tüdőrák, gyomorrák, húgyhólyagrák esetén); a „HRT kedvezőtlen hatású, ezért ellenjavallt” (például emlőrák, endometrium-, stromasarcoma, meningioma, glioma, hormonreceptor-pozitív gyomor- és hólyagrák).
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.