Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 310
Intracranialis meningeomák gamma-sugársebészeti kezelésének lehetőségei. Szakmai irányelvek, tapasztalatok
A meningeomák az egyik leggyakrabban előforduló, többnyire jóindulatú intracranialis daganatok, melyek az arachnoidea meningothelialis sejtjeiből származnak. Lokalizációjukat tekintve változatosak, a központi idegrendszer bármely területén elhelyezkedhetnek, ahol agyburkok is megtalálhatók. Tüneteket azáltal okoznak, hogy a környező ép agyállományra vagy képletekre direkt nyomást gyakorolnak, azok normális működését akadályozzák. Tüneteket ennek ellenére sokszor csak későn okoznak, mivel egy ideig az agy jól kompenzálja a daganat által okozott változásokat. Ebben a stádiumban elfogadott a követés, a konzervatív hozzáállás. A műtéti indikációt bizonyított növekedés, térfoglalás, oedema megjelenése, kieséses tünet vagy epilepszia megjelenése esetén állítunk fel. A daganat progressziója esetén elsősorban nyílt műtét lehetősége merül fel. A reziduális tumorszövet kontrollálására magas kockázatú műtétek eseteiben, amennyiben a lehetőségek azt megengedik, sugársebészeti, sugárterápiás beavatkozások lehetnek szükségesek, akár a hagyományos műtétek kiegészítéseként.
EEG-alapú agyi funkcionális konnektivitásvizsgálat epilepsziákban
A krónikus fájdalomszindrómák több mint 80 millió embert érintenek Európában. A gyógyszeres kezelésre nem reagáló deafferentációs fájdalmak csökkentésére már 1954-ben publikálta Heath a mély agyi stimulációs módszert.
A Huntington-kór epidemiológiája és aktuális kérdései
Bevezetés: Az elmúlt időszakban számos tanulmány látott napvilágot, ami a Huntington-kórban szenvedő betegek, illetve a tünetmentes hordozók kezelését tűzi ki célul, ugyanakkor a felmerülő nehézségekből adódóan áttörő terápiás eredményt egyelőre nem sikerült elérni. Az eredményes terápia egyik alapfeltétele a betegpopuláció klinikai és genetikai epidemiológiai jellemzőinek mélyreható ismerete. Módszerek: A Szegedi Tudományegyetem Neurológiai Klinikáján Huntington-kórral diagnosztizált betegek fenti jellemzőit két folytatólagos tanulmány keretében vizsgáltuk. Az első, 1999-ben megjelent, magyarországi populációs genetikai jellemzőket először publikáló vizsgálatban ugyan számos paraméter (például CAG-ismétlődés hosszeloszlása, az expandált allél szülői eredetének vizsgálata, anticipáció kérdésköre, preszimptómás esetek frekvenciája) már tanulmányozásra került, ugyanakkor például az intermedier allélok kérdéskörével kevésbé foglalkozott. A második tanulmányunkba – melynek során a rendelkezésre álló elektronikus orvosi adatbázisokban folytattunk keresést a Betegségek Nemzetközi Osztályozásában (BNO) szereplő G10H0 kódra az 1998. január 1. és 2018. december 31. közötti időszakban, továbbá áttekintettük az erre a periódusra vonatkozó, papír alapú járóbeteg-dokumentációt – 90 Huntington-kóros beteget (45 férfi és 45 nő), valamint 34 tünetmentes hordozót (15 férfi és 19 nő) tudtunk bevonni. Eredmények: A medián életkor a tünetek megjelenésekor 45 év volt (16–79 év). Fiatalkori (juvenilis) betegségkezdetet 3 esetben (3,3%), míg késői betegségkezdetet 7 esetben (7,8%) találtunk. A medián CAG-ismétlődésszám a patológiás allélok vonatkozásában 43 (36–70), míg a nem patológiás allélok esetében 19 (9–35) volt. A patológiás allélok 17,5%-a a csökkent penetranciájú, míg a nem patológiás allélok 7%-a az intermedier tartományba esett. Következtetés: A két tanulmányban vizsgált populáció jellemzőiben nem találtunk számottevő különbséget, és azok megfelelnek a rendelkezésre álló nemzetközi szakirodalomban szereplő adatoknak is. Kivétel ez alól a csökkent penetranciájú, illetve intermedier tartományba eső allélok magasabb aránya. Ennek különös jelentőségét az adja, hogy ezen alpopulációk alkalmasak leginkább azon faktorok tanulmányozására, melyek a betegség manifesztációját meghatározzák, ezáltal jövőbeli eredményes terápiás próbálkozások alapjait képezhetik.
Fehérállományi neuronok és szerepük a temporalislebeny-epilepsziában
A temporalislebeny-epilepszia (TLE) az egyik leggyakoribb felnőttkori farmakoterápia-rezisztens epilepszia, melyben a hippocampalis elváltozások mellett jelentős patológiás elváltozások találhatók a neocorticalis területeken is. Ismert, hogy a TLE-betegek agykérgi fehérállományában szignifikánsan nagyobb számban vannak jelen neuronok, mint nem epilepsziásokban, abban az esetben is, ha képalkotó eljárásokkal a neocortex területén nem látható eltérés. Korábbi vizsgálataink során kimutattuk, hogy a fehérállományi neuronok között vannak mind serkentő, mind gátló neuronok. Eredményeink arra utaltak, hogy a fehérállományi neuronok jelentős része a magzati korban átmenetileg jelen lévő subplate maradványaként van jelen, míg másik részük feltételezhetően a vándorlás során a fehérállományban rekedt populáció.
Étkezés mint rohamkiváltó faktor temporalislebeny-epilepsziában
100 beteg videóanalízis-vizsgálata során rögzített 596 epilepsziás roham került elemzésre. A rohamot megelőző 60 perc hosszúságú időintervallumot tanulmányoztuk aszerint, hogy volt-e étkezés; amennyiben igen, rögzítettük a táplálékbevitel és a roham indulása közötti latenciát.
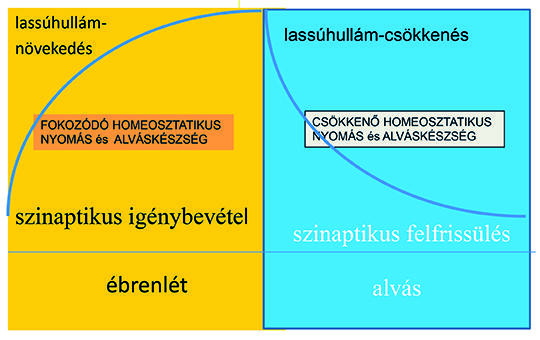
Nézetváltozások az epilepszia keletkezéséről és mechanizmusáról. Rendszeralapú megközelítés
Az epileptogenesis útjainak vizsgálata a rendszerepilepszia-koncepció mentén. Irodalmi áttekintés és saját tapasztalatok alapján ismertetjük a deklaratív memóriarendszer, az alvás/ébredés és a perisylvian kommunikációs rendszer epilepsziás átalakulását, majd az epileptogenesis folyamatát bemutatjuk az agyi sérülések és a poszttraumás epilepszia modelljén is. Az ismertetett rendszer-epilepsziák kialakulásában közös lépések ismerhetők fel a plaszticitás és a NREM-alvás alatti szinaptikus homeosztázis felfokozódásában, ami egyben rávilágít az alvás döntő szerepére epilepsziában. Megkíséreljük körvonalazni a rendszerepilepszia-koncepciót, és az egymással összefüggő plaszticitás – alvási szinaptikus homeosztázis „kisiklása” formájában rámutatunk az epileptogenesis lehetséges közös patomechanizmusára.
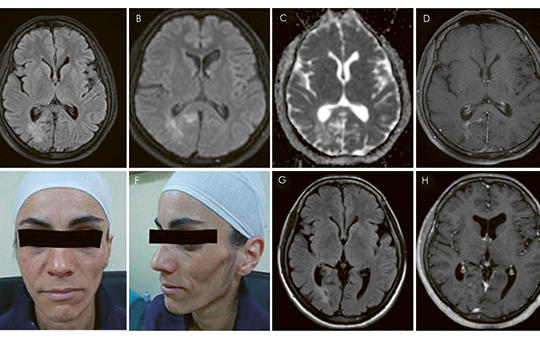
[Relapszáló-remittáló betegségnek tarthatjuk-e a Parry–Romberg-szindrómát?]
[A progresszív hemifacialis atrophia néven is ismert Parry– Romberg-szindróma ritka, lassan progrediáló betegség, amit az arcbőr és az arc bőr alatti kötőszöveteinek egyoldali, fájdalmatlan atrophiája jellemez. A kórkép viszonylag gyakran (az esetek 15–20%-ában) jár együtt neurológiai manifesztációkkal (epilepszia, migrén, trigeminusneuralgia). A lehetséges okok között a következő etiológiai tényezőket tartják számon: fertőzés, az embrionális fejlődés zavara, szimpatikus diszfunkció, autoimmun betegség. Esetismertetésünkben bemutatjuk egy 37 éves nő kórtörténetét, akinek betegsége kétéves periódusban relapszáló-remittáló betegséglefolyásra emlékeztető, dinamikus kontrasztfokozott fehérállomány-elváltozásokkal jelentkezett. Szisztémás gyulladásos aktivitást, gyulladásos jeleket a cerebrospinalis folyadékban, pozitív szérum-autoantitesteket mutattunk ki, ami a beteg korábban felfedezett autoimmun betegségével együtt az autoimmun-gyulladásos kóreredet hipotézisét támogatja.]
Magas aktivitású sclerosis multiplex hatásos kezelése gyermekkorban
A sclerosis multiplex (SM) jellemzően a fiatal felnőttek betegsége. Gyermekkori sclerosis multiplexről 18 éves kor alatt kezdődő megbetegedés esetén beszélhetünk, bár egyes szerzők 16 éves kor alatt szabják meg a határt. Korábban „early onset multiple sclerosis”, illetve „juvenilis sclerosis multiplex” néven vált ismertté. A gyermekkori SM előfordulási gyakorisága az összes SM 3–5%-a. Napjainkban, köszönhetően az egyre jobb diagnosztikai eszközöknek és a jól követhető, szigorúan meghatározott diagnosztikus kritériumoknak, a gyermekkori SM incidenciája világszerte növekszik (0,05–2,85/100 000). Az SM-et térben és időben elkülöníthető, ismétlődő központi idegrendszeri demyelinisatióval jellemezhető epizódok jellemzik. Gyermekkorban csaknem kizárólag a relapszáló-remittáló (RR) forma fordul elő. A felnőtteknél szerzett tapasztalatokra építve a gyermekpopulációban szintén a korai diagnózis, az adekvát betegségmódosító terápia (DMT) mielőbbi indítása, a tünetmentesség és a jó életminőség elérése a cél. A felnőtt populációban végzett hatékonysági és biztonságossági vizsgálatok alapján a gyermekkori SM kezelésében az FDA és az EMA először az interferon β-1a-t és a glatiramer acetátot engedélyezte. A gyermekkori SM-re jellemző magas relapsusráta és az első DMT-re közel 45%-ban adott kedvezőtlen terápiás válasz szükségessé tette a hatékonyabb és második vonalbeli szerek vizsgálatát a 18 év alatti populációban is (PARADIGMS, CONNECT). A nemzetközi közlemények szerint a natalizumab hatékony és jól tolerálható az aktív RR gyermekkori SM-ben, de kontrollált tanulmány hiányában az esetismertetésünkben szereplő betegeinknél evidencia még nem állt rendelkezésre. Közleményünkben haárom aktív RR-SM-ben szenvedő betegünk indikáción túli, egyedileg engedélyeztetett natalizumabbal végzett sikeres kezeléséről számolunk be.
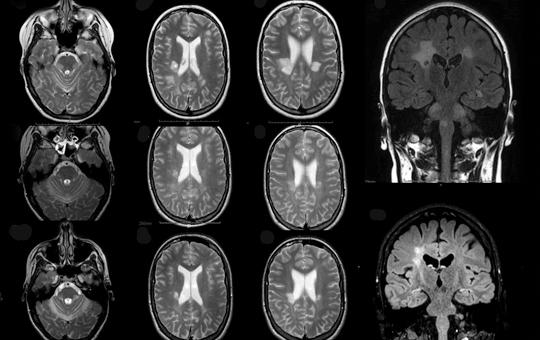
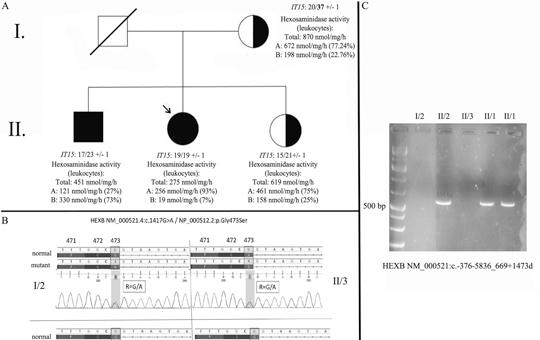
[Késői kezdetű Sandhoff-betegség atípusos jelentkezése: esetismertetés]
[Bevezetés – A Sandhoff-betegség egy olyan ritka, hereditaer GM2-gangliosidosis (autoszomális recesszív), amit a HEXB gén mutációja okoz. A hexózaminidáz (Hex) enzim β-alegységének károsodása miatt mind a Hex-A, mind a Hex-B izoformák működése zavart szenved. A betegség súlyossága, valamint a tünetek kezdete (infantilis vagy klasszikus, juvenilis, felnőttkori) a residualis enzimaktivitás függvénye. A késői kezdetű formát szerteágazó tünettan jellemzi. Jelen lehetnek többek között motoneuronbetegségre utaló eltérések, ataxia, tremor, dystonia, valamint pszichiátriai és neuropathiára utaló jegyek is. A 36 éves nőbeteg 9 éve tartó, progresszív, szimmetrikus alsó végtagi gyengeség miatt jelentkezett klinikánkon. A részletes neurológiai szakvizsgálat enyhe fokú szimmetrikus gyengeséget igazolt a csípőflexorokban, a többi izomcsoport megkíméltsége mellett. Mindkét oldalon a Patella-reflex renyhe volt. A laboratóriumi vizsgálatok releváns eltérést nem mutattak. A rutin elektro-encefalográfiás, valamint a koponya-MR-vizsgálatok a beteg panaszait magyarázó eltérést nem detektáltak. Az elektroneuronográfiás, valamint az elektromiográfiás vizsgálatokon szenzoros neuropathiának megfelelő eltérések látszottak. Az izombiopsziás minta elemzése kapcsán enyhe fokú neurogén károsodásra derült fény. A beteg öccse (32 éves) hasonló tüneteket mutat. Páciensünk részletes genetikai vizsgálata során két ismert patogén eltérést találtunk a HEXB génben, egy missense mutációt, valamint egy 15 008 bázispár hosszúságú deletiót (NM_000521.4:c.1417G>A; NM_000521:c.-376-5836_669+1473del; kettős heterozigóta állapot). A szegregációanalízis, valamint a családtagok hexózaminidáz-vizsgálata a késői kezdetű Sandhoff-betegség diagnózisát megerősítették. A jelen esetismertetés célja, hogy felhívja a figyelmet a késői kezdetű Sandhoff-betegség differenciáldiagnosztikai jelentőségére felnőttkorban kezdődő, proximális predominanciát mutató szimmetrikus alsó végtagi gyengeség esetén.]
Epilepsziával járó autoimmun encephalitis miatt kezelt betegek klinikai összegzése epilepsziacentrumban
Az autoimmun encephalitisek a kóros, gyakran epilepsziát okozó immunológiai folyamatok széles körét ölelik föl, melyekben számos esetben kimutathatók neuronalis intracelluláris vagy sejtfelszíni antigének ellen termelődő antitestek. A betegség prevalenciáját napjainkban is alábecsülik, a diagnosztikus lépések és a pontos kezelési metodika nem teljesen tisztázott. Célunk az Országos Klinikai Idegtudományi Intézet Epilepszia Részlegén autoimmun encephalitis miatt gondozott betegek egyes alcsoportjai közötti klinikai, radiológiai, pszichopatológiai és elektrofiziológiai különbségek összegzése. Összesen 40 beteget választottunk be vizsgálatunkba; a betegeket a detektált antitestek, a klinikai, radiológiai, elektrofiziológiai szempontok alapján 9 különböző csoportba soroltuk. A legtöbb (n=11) beteg esetében GAD elleni antitestet találtunk, GABA-B receptor elleni antitest a legkevesebb, 1 beteg esetében volt. A legalacsonyabb átlagéletkorral (16,7 év) a posztinfekciós encephalitisszel (FIRES) diagnosztizált betegek, a legmagasabbal (50,4 év) a paraneoplasiás antitesteket termelő betegek rendelkeztek. A társbetegségeket megfigyelve az anti-GAD antitesttel rendelkezők több mint felének autoimmun pajzsmirigybetegsége volt. A vizsgált vasculitisszel diagnosztizált, anti-GABA-B antitesttel rendelkező és Rasmussen-kórban szenvedő betegeknél a koponya-MRI-vizsgálaton a betegségükkel összefüggő eltérés látszott, míg akiknél paraneoplasiás vagy anti-NMDA antitestet detektáltunk, a betegséggel összefüggésben lévő MRI-eltérés nem igazolódott. Az egy csoportba sorolt betegek antiepileptikus, illetve immunszuppresszáns kezelésre adott válasza is hasonló volt. A felszíni antigének ellen termelődött antitesttel bíró betegek esetén jobb volt a terápiás válasz, a leginkább terápiarefrakter betegek a Rasmussen- és a FIRES-csoportba tartoztak. Az autoimmun encephalitis egyes alcsoportjainak fenotípusa hasonló, de a klinikai megnyilvánulás, az EEGés az MR-vizsgálatok átfogó értékelése segíthet egy jól meghatározott rendellenesség diagnosztizálásában. Néhány példát említve, a pajzsimigybetegséggel társuló, MRI-negatív epilepszia hátterében anti-GAD-pozitív encephalitis is állhat. Memóriazavarral, TGA-val járó rosszullétek esetén későbbi életkorban paraneoplasiás mechanizmust is feltételezhetünk, ez segíthet malignus folyamat felfedezésében. Az autoimmun encephalitisben szenvedő betegekre csoportspecifikusan más-más klinikai minták igazak, és egy-egy csoportra különböző terápiás szükséglet, illetve különböző terápiás válasz jellemző. A jövő kihívása többek között a betegség korai felismerése, az encephalitis hátterében álló immunpatológiai folyamatok pontosabb megértése, és a megfelelő időben történő célzott kezelés kidolgozása, melyhez további vizsgálatok szükségesek.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.