Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 181
Idegtudományok
2022. MÁJUS 17.
Centrális vénajel a sclerosis multiplex képalkotó diagnosztikájában
A sclerosis multiplex (SM) diagnosztikáját jelentősen megnehezíti, hogy számos kórkép, mint például a migrén, bizonyos vascularis eltérések és egyéb gyulladásos megbetegedések, az SM-hez hasonló képet mutat. Az SM diagnosztikájában használt McDonald-kritériumrendszer az egyértelműen demyelinisatióra utaló esemény megléte esetén jól működik, ugyanakkor az atípusos, nonspecifikus vagy tünetmentes betegekben hibás SM-diagnózishoz vezethet, főleg, ha az MR-képanyag olyan eltéréseket mutat, melyek ismeretlen jelentőséggel bírnak. A centrális vénajel megfelelő határértékek megválasztása esetén magas specificitással bír az SM és az SM-utánzó kórképek differenciálásánál. A T2*-súlyozott szekvenciák alkalmazása tovább növelheti a jel szenzitivitását is.
Idegtudományok
2021. NOVEMBER 11.
Klinikai döntéshozatal MOG antitest-asszociált betegségben
A szenzitív és specifikus sejtalapú esszék kifejlesztésével a humán myelin-oligodendrocyta glikoprotein (MOG) ellenes IgG-antitestek kimutatása lehetővé tette az anti-MOG antitest-asszociált betegség (anti-MOG antibody-associated disease, MOGAD) és az egyéb demyelinisatiós betegségek elkülönítését. A MOGAD, az aquaporin-4-asszociált neuromyelitis optica spektrum betegség (AQP4-NMOSD) és a sclerosis multiplex (SM) megkülönböztetését a betegségek különböző kórélettani háttere, klinikuma, terápiás és prognosztikus következményei egyaránt indokolják.
NMDAR-encephalitissel átfedő demyelinisatiós szindróma – diagnosztikai és terápiás kérdések
Az anti-N-metil-D-aszpartát-receptor (NMDAR-) encephalitis az NMDAR GluN1 alegysége elleni IgGantitestekkel társuló autoimmun kórkép. A tünetek súlyossága ellenére csak a betegek 35%-ánál mutatható ki koponya-MRI-vel károsodás, ami leggyakrabban monofázisos formában fordul elő. A legfrissebb adatok alapján azonban az anti-NMDAR encephalitisben szenvedők kis százalékánál további relapszusok jelentkezhetnek, melyek hátterében demyelinisatiós laesiók mutathatók ki. A szakirodalomban egyre több adat lelhető fel, miszerint az NMDAR-encephalitis átfedést mutathat más autoimmum, demyelinisatiós kórképpel, leggyakrabban neuromyelitis optica spektrum betegséggel (főként anti- MOG ellenanyag-pozitív estekben), ritkábban sclerosis multiplexszel. A felmerülő diagnosztikai nehézségeket egy eset kapcsán mutatjuk be. A 24 éves férfi pszichiátriai beutalást követően 2 hónapos tünetkezdetet követően először 2014 májusában került felvételre a Neurológiai Klinikára memóriazavar, bal oldali latens hemiparesis kivizsgálása céljából. Akkor készült koponya-MRI-n disszeminált, gócos agyi folyamat ábrázolódott, gyűrűszerű kontrasztanyag-halmozással, kétoldali hippocampus-érintettséggel. A látott kép leginkább ADEM-nek felelt meg. A liquorban oligoklonális gammopathia látszott. A virális és paraneoplasiás eredetet kizártuk. Intravénás szteroidterápiára átmeneti javulás jelentkezett, azonban a terápia leépítését követően ismételt állapotrosszabbodás következett be. A szteroidterápia ismétlése érdemi változást nem hozott, plazmaferézisben részesült, azathioprinterápiát kapott. A diagnosztikai vizsgálatok során az ellenanyag-vizsgálat alapján anti- NMDAR encephalitis diagnózist állítottuk fel. PET CTvel követtük 3 évig. Állapota stagnált, koponya-MRI-n sem jelent meg új laesio, kifejezett jobb oldali hippocampalis atrophia látszott. Imuran elhagyását követően 2 évvel kettős látása jelentkezett, koponya-MRI-vizsgálaton novum fehérállományi laesiók jelentek meg. A látott radiológiai kép és a korábbi liquorlelet, valamint a klinikum alapján felmerült sclerosis multiplex lehető- sége, intravénás nagy dózisú szteroidterápiát alkalmaztunk. Szérum-aquaporin-4, anti-MOG, anti-NMDAR ellenanyag- vizsgálat a szteroidterápiát követően készült, negatív eredményt adott. A szakirodalmat részletesen áttekintve az anti-MOG ellenanyag-pozitív NMO szövődik leggyakrabban az NMDA-R encephalitisszel átfedő demyelinisatiós szindrómával, a sclerosis multiplex ettől jóval ritkább. A közös hatékony terápiás opció a rituximab, aminek támogatását kérvényeztük.
Ellentmondások a neurológiában: A sclerosis multiplex diagnózisának, követésének és terápiájának aktuális kérdései a patomechanizmus megközelítésével
A sclerosis multiplex relapszáló-remittáló és progresszív formái közötti határvonal sokszor nehezen megállapítható. A kórkép különböző klinikai megjelenései (fenotípusai) ellenére nincs egyértelmű biológiai oka az egyes formák elkülönítésének. Mind a primer progresszív, mind pedig a szekunder eseteknél ugyanis hasonló patológiai eltérések észlelhetők a gyulladásos infiltráció, az axonalis károsodás és a corticalis demyelinisatio vonatkozásában. Felmerül a kérdés, hogy a primer progresszív sclerosis multiplexet megelőzheti egy aszimptomatikus (fel nem ismert) relapszáló-remittáló fázis. A szekunder progresszív sclerosis multiplex meghatározásához a betegnek 4-es EDSS-értéke kell, hogy legyen. Következésképpen a klinikai progresszió a korai fázisban kevéssé követett a betegeknél. Ismert továbbá a relapszusoktól függetlenül előrehaladó progresszió, ami észlelhető a betegség relapszáló-remittáló fázisában. A háttérben zajló lappangó, parázsló celluláris/molekuláris folyamatok meghatározzák a klinikai történést, amik a gyógyszeres terápia fontos célpontjai lehetnek. Ugyanakkor a proinflammatorikus citokinek összefüggésbe hozhatók a rosszabbodó kognícióval. Ez a gyulladásos környezet igen komolyan közrejátszhat a relapszus alatt megfigyelt mentális állapot kialakulásában. A betegeknél a motoros (fizikai) rosszabbodást jóval megelőzően rejtett kognitív teljesítménycsökkenés észlelhető. A relapszáló-remittáló fázisban észlelt silent progression pedig kapcsolatban lehet az agyi atrophia előrehaladásával. Levonható tehát az a következetés, hogy a szekunder progresszív fázisban észlelt folyamat jóval előbb elkezdődhet. Ezek az adatok a sclerosis multiplex egységes szemléletét erősítik, és felvetik a lehetőséget, hogy a betegség valójában egy primer progresszív kórkép, amire relapszusok rakódnak.
A krónikus neurológiai Covid-tünetek hátterében álló mechanizmus
Bár a hosszú Covidnak nevezett krónikus tünetegyüttes diszexekutív szindrómával vagy ködös agyműködéssel járhat, az eddigi vizsgálatok nem találtak a tünetek hátterében encephalitist. Amerikai patológusok most megfejtették a mechanizmust, ami legalábbis részben magyarázhatja a neurológiai tüneteket.
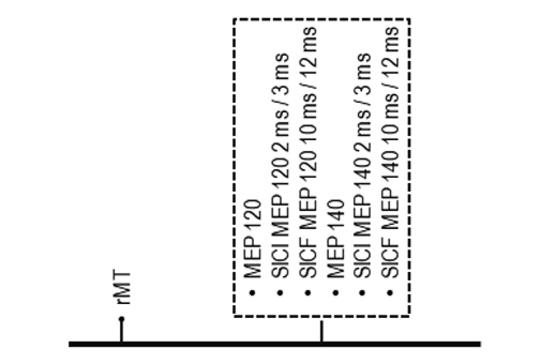
[A transcranialis mágneses stimulációval végrehajtott folyamatos 30, 50 és 100 Hz-es θ-hullám-ingerlés hatásai egészséges személyek elektrofiziológiai paramétereire]
[A transcranialis mágneses stimuláció robusztus mágneses mezőket használó, nem invazív eljárás, amivel elektromos áramlást lehet előidézni a nagyagykéregben. A kettős stimuláció küszöb alatti kondicionáló stimulust (CS), majd küszöb feletti tesztstimulust (TS) alkalmaz. Amikor a két stimulus közötti időtartam (interstimulus interval, ISI) 1–6 msec, a kiváltott motoros potenciál amplitúdója (MEP) csökken; ennek a csökkenésnek a neve rövid intervallumos intracorticalis gátlás (SICI). 7–30 msec ISI esetén a MEP-amplitúdó nő, ennek neve rövid intervallumos intracorticalis facilitáció (SICF). A leggyakrabban 50 Hz frekvenciával alkalmazott folyamatos θ-hullám-ingerlés (cTBS) kimutathatóan csökkenti a corticalis ingerelhetőséget. A jelen vizsgálat elsődleges célja az volt, hogy meghatározzuk, milyen időtartamú cTBS révén lehet jobb gátlást, illetve serkentést elérni. A vizsgálat másodlagos célja az 50 Hz-es cTBS hatásának összehasonlítása volt a 30, illetve 100 Hz-es cTBS hatásával. A nyugalmi motoros küszöb (rMT), a MEP, a SICI és a SICF értékeit 30 egészséges önkéntes esetében tanulmányoztuk. A SICI esetében 2 és 3 msec intervallummal az rMT 70–140%-át használva alkalmaztuk a CS-t és a TS-t, míg SICF esetében 10 és 12 msec intervallumokat használtunk. Minden csoportban 10 személy kapott 30, 50 vagy 100 Hz-es ingerlést, ezt követően azonnal és 30 perc elteltével rögzítettük az rMT, az MT-MEP, a SICI és a SICF értékeit. A SICI-ben nagyobb gátlást lehetett elérni 3 msec-mal, mint 2 msec-mal, míg a SICF-ben nagyobb serkentést lehetett elérni 12 msec-mal, mint 10 msec-mal. 30 Hz-en a cTBS segítette a gátlást és gátolta a serkentést, míg az 50 Hz-es stimuláció kevesebb gátlást és nagyobb interindividuális variabilitást eredményezett. A 100 Hz-es stimuláció hatására a cTBS csekély serkentést eredményezett a MEP-amplitúdókban, kevesebb interindividuális variabilitással. A SICI és a SICF nem különbözött szignifikáns mértékben 50 és 100 Hz-es cTBS esetén. Vizsgálatunk szerint a 3 és 12 msec-os SICI és SICF alkalmazása, valamint a 80–120%-os rMT-vel alkalmazott CS és TS biztonságosabb gátlást és serkentést eredményez. A közelmúltban különféle neurológiai betegségek kezelésére kezdték használni a TBS-t; eredményeink alapján az 50 Hz-es helyett inkább a 30 Hz-es cTBS-stimuláció használatát javasoljuk, mivel nagyobb biztonságosság és kisebb interindividuális variabilitás mellett nagyobb gátlást eredményez. ]
Fókuszban
2020. NOVEMBER 30.
A teriflunomid és a dimetil-fumarát hatása a corticalis atrophiára és leptomeningealis gyulladásra sclerosis multiplexben: egy retrospektív, obszervációs, eset-kontrollos pilot vizsgálat
Egy retrospektív, egycentrumos, obszervációs, longitudinális, egyes vak vizsgálatban a teriflunomid a dimetil-fumaráthoz képest szignifikánsan jobb eredményeket mutatott a szürkeállomány, illetve a cortex megőrzésének terén.
Fókuszban
2020. NOVEMBER 30.
A teriflunomid hatása az Epstein–Barr-vírusra adott humorális válaszra és a corticalis szürkeállomány elváltozásainak kialakulására sclerosis multiplexben
Egy prospektív, obszervációs, longitudinális, 12 hónap hosszú vizsgálatban relapszáló sclerosis multiplexes betegek teriflunomidkezelésben részesültek. Az MRI-eredmények (például az agyi atrophia mértéke) alapján nem jelentkezett szignifikáns eltérés az egészséges, azonos korú kontrollszemélyekkel összehasonlítva. Az EBV elleni antitestek szintjének csökkenése erősen korrelált a cortex, valamint a szürkeállomány mennyiségének alacsonyabb szintű csökkenésével. A teriflunomid az EBV okozta immunválasz csökkentésén keresztül fejtheti ki pozitív hatását.
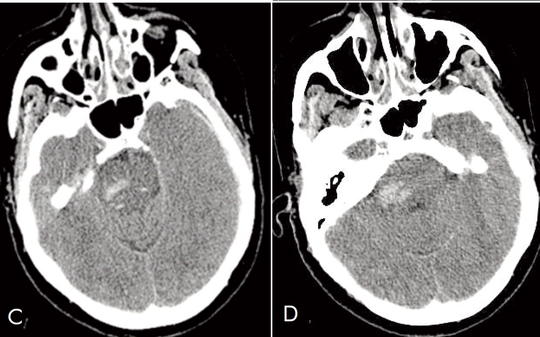
[Subduralis, subarachnoidealis és állományi vérzés egyidejű kialakulása perifériás arteria cerebri media aneurysmaruptura után]
[Az agyi állományvérzés leggyakoribb oka hypertonia, a subarachnoidealis vérzésé érmalformáció megrepedése, a subduralis haematomáé rendszerint koponyatrauma. E háromféle vérzés egy időben, közös okra visszavezethetően ritkán alakul ki. Az intracerebralis aneurysmák gyakorisága a Willis-körtől távolodva csökken, az a. cerebri media distalis szakaszán alig fordul elő, ezek az esetek szinte mindig úgynevezett mycoticus aneurysmák, melyek általában súlyos immundeficiens állapotokban, endocarditisben alakulnak ki. Az 59 éves nőbeteg anamnézisében hypertonia, diétával egyensúlyban tartott diabetes mellitus szerepelt. Trauma nem érte. Felvételére egy napja fennálló, mind kifejezettebb szótalálási nehézség, bal oldali fejtetői fájdalom miatt került sor. Felvételekor enyhe motoros aphasiát észleltünk. Érkezése után néhány perccel comatosussá vált, légzése felületes lett. CT-vizsgálattal bal oldalon, frontoparietalisan subduralis és subarachnoidealis vérzés, mellette állományvérzés ábrázolódott, jobb oldalon a ponsban is állományvérzés látszott. Haemostatisa rendben volt. A subduralis haematoma evacuatióját követően gépi lélegeztetésre volt szükség. Szepszis alakult ki, MRSA igazolódott. Széles spektrumú antibiotikum mellett többször szorult transzfúzióra. Echokardiográfia vegetációt nem igazolt. Neurológiai státusza, vigilitasa fokozatosan javult, per os táplálhatóvá vált. A megkezdett rehabilitációt GM status epilepticus szakította meg. Koponya-CT, CT-angiográfia bal oldalon, az a. cerebri media perifériás szakaszán aneurysmát igazolt. Fizikális státusza alapján két hónappal később vált alkalmassá műtétre, melynek során bal oldali hátsó frontális feltáráson keresztül a corticalis felszínen elhelyezkedő aneurysmát két clippel elláttuk. A műtéti lelet és az érfalból készült szövettani vizsgálat „valódi”, nem mycoticus aneurysmát igazolt. Betegünk kórtörténetének különlegessége az egyidejűleg kialakult érmalformáció okozta subduralis, subarachnoidealis és agytörzsi, infratentorialis vérzés. Az igazolódott aneurysmaesetünk lokalizációjában rendkívül ritka. Még inkább különleges, hogy nem mycoticus aneurysma volt. A beteg maradványtünetekkel, de aktív életet él.]
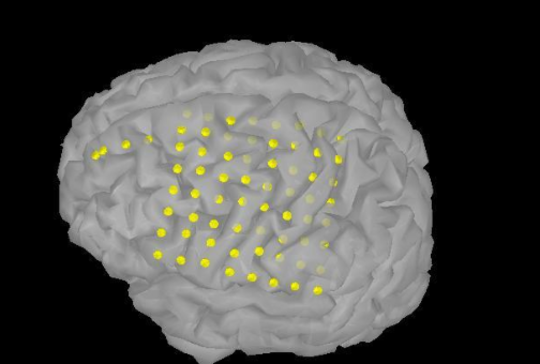
Intracranialis EEG-monitorozási eljárások
Gyógyszerrezisztens epilepsziabetegség esetén a reszektív sebészeti beavatkozás nyújtja a legjobb esélyt a rohammentességre. Elokvens kérgi área mellett elhelyezkedő rohamindító zóna, vagy extratemporalis betegek MR-negativitása, vagy diszkordáns preoperatív vizsgálati eredmények esetén intracranialis EEG-vizsgálat elvégzése szükséges.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.