Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 396
Neuroborreliosis által okozott kisérvasculitis diagnózisa és komplex kezelése
Bevezetés: A neuroborreliosis a Lyme-kór korai vagy késői szövődménye, ami a fertőzöttek 10-15%-ában alakul ki a B. burgdorferi hematogén vagy közvetlenül a perifériás, illetve agyidegek mentén történő terjedése révén. A korai stádiumban lymphocytás meningitis, agyidegtünetek, polyradiculopathia, a késői stádiumban myelitis, ritkán encephalitis jelentkezhet. Központi idegrendszeri vasculitis a fertőzöttek 0,3–1%-ában alakul ki, jellemzően a vertebrobasilaris rendszerben. Főként a nagy, de ritkán a kisereket is érinti. Szekunder profilaxisként célzott antibiotikum-terápia alkalmazandó, ezért fontos a fertőzés kimutatása. Módszer: Egy 52 éves férfi beteg esetét mutatjuk be, aki hirtelen kialakult dysarthria, poliglott aphasia, járási és törzsataxia miatt jelentkezett kivizsgálásra. A koponya- MR-vizsgálat által igazolt multiplex ischaemiás laesiók lokalizációja, valamint az emelkedett liquorösszfehérje alapján felmerült kisérvasculitis lehetősége. A beteg állapota egy héten belül romlott, a kontroll-MR-vizsgálat a laesiók számának jelentős növekedését igazolta. HIV, HBV, HCV, HSV1, VZV, Borrelia, lues szűrővizsgálatokat végeztünk, illetve szisztémás autoimmun betegségekben megjelenő autoantitesteket vizsgáltunk (ANA, ANCA, anti-SSA, anti-SSB, anti-DNS, anti-Scl-70, anti- Jo-1, anti-Sm, anti-beta-2-glikoprotein, anti-cardiolipin). B. burgdorferi elleni antitest jelenlétét igazoltunk a szérumban és a liquorban. A liquor-/szérumantitest arány intrathecalis antitestképzést bizonyított. (A többi vizsgálat negatív eredménnyel zárult.) A beteget a terápiás protokollnak megfelelően iv. ceftriaxonnal kezeltük. A beteg állapota a kezelés után tovább romlott, az ismételten elvégzett kontroll-koponya-MR a laesiók számának és méretének progresszióját igazolta. Ekkor immunológus bevonásával per os szteroid- és azathioprinkezelést kezdtünk. A kontroll-MR-vizsgálatok további progressziót igazoltak, ezért rituximabra váltottunk, mely mellett a beteg állapota klinikailag javult, a képalkotó vizsgálatok újabb laesiókat nem mutattak ki. Eredmények: A fenti vizsgálatok alapján neuroborreliosissal összefüggésbe hozható kisérvasculitist állapítottunk meg. Következtetés: Tekintettel arra, hogy a betegség a célzott antibiotikum-kezelést követően is progrediált, felvetjük parainfekciózus immunmediált patomechanizmus lehetőségét.
IVIG-en innen és túl – A CIDP kezelési lehetőségei kórházunk adatai alapján
A krónikus gyulladásos demyelinisatiós polyneuropathia (CIDP) a perifériás idegrendszer betegsége, ami kezelés nélkül maradandó rokkantságot okozhat. A kórházunkban gondozott betegek adatait tekintettük át az alkalmazott terápia típusának és hatékonyságának megítélése, a terápia okozta mellékhatások és azok gyakoriságának felmérése céljából. Az adatokat az országos CIDP-regiszterből, illetve a kórházi medikai rendszerből nyertük. A diagnosztikai kritériumok minden esetben teljesültek. A betegség típusos tünetekkel járt, 1-1 esetben észleltünk tisztán szenzoros formát, illetve DADS-variánst. Az átlagos életkor a betegség kezdetekor 52 év (medián) volt. 5 esetben először Guillain–Barré-szindróma, egy-egy esetben pedig polyneuropathia és kétoldali carpalis alagút szindróma volt a kezdeti diagnózis. A leggyakrabban alkalmazott kezelés az intravénás immungobulin (IVIG) volt, de több páciensnél végeztünk plazmaferézist, illetve néhány esetben tartós immunszuppresszív terápia is beállításra került. Két esetben autológőssejt-transzplantáció történt. A terápiák hatékonyságának megítélését nehezítette, hogy a mindennapi közkórházi gyakorlatnak nem része a pontozóskálák felvétele. Szteroidterápia egy esetben volt hatástalan, adekvát dózisú és időtartamú adagolás ellenére. Plazmaferézis vagy IVIG mellett a betegek többsége egyensúlyba került. Súlyosabb relapszusok esetén a beállított immunszuppresszív kezelés is hatékonynak bizonyult 1-1 esetben. A leggyakoribb mellékhatás az Imuran okozta hasi panaszok és laboreltérések voltak, két esetben fordult elő tartós szteroidkezelés következményeként osteoporosis kompressziós csigolyatörésekkel, egy esetben IVIG-kezeléshez társuló fejfájás. Összefoglalás: A krónikus gyulladásos demyelinisatiós polyneuropathia jól felimerhető és diagnosztizálható betegség, ami jól reagál adekvát dózisban és megfelelő ideig alkalmazott terápiára, így a tartós rokkantság megelőzhető. Kellő odafigyeléssel a kezelések mellékhatásai is kivédhetők.
Anti-GAD cerebellaris ataxia terápiás nehézségei
Bevezetés: A GAD- (glutamát-dekarboxiláz-) ellenes antitestekkel asszociált cerebellaris ataxia ritka, többnyire lassú progressziót mutató kórkép. Jellemző tünetei a törzs- és végtagataxia, a dysarthria és a nystagmus. Normál liquorfehérje-érték és -sejtszám mellett a betegek egy részében oligoclonalis gammopathia mutatható ki. A koponya-MR-en a betegség fennállásának függvényében látható különösen a vermist érintő cerebellaris atrophia. Igen gyakori társulást mutat szisztémás autoimmun betegségekkel. A kimenetel a betegség kialakulásával (szubakut vs. krónikus) és a cerebellaris atrophia fokával mutat korrelációt. Enyhe fokú vagy hiányzó cerebellaris atrophia esetén a betegek várhatóan jobban reagálnak az immunterápiára. Az MR-en látható atrophia fokából valamelyest becsülhető a cerebellaris rezerv. Esetbemutatás: 35 éves férfi betegünk felvételére közel két éve induló, hosszabb tünetmentes periódusokat is mutató egyensúly-bizonytalanság kifejezett, szubakut rosszabbodása miatt került sor. Az immun cerebellaris ataxia diagnózisa a felvételét megelőző napokban igazolódott. Anamnéziséből vitiligo és Hashimoto-thyreoiditis emelhető ki. A korábbi koponya-MR-vizsgálaton kifejezett kisagyi atrophia ábrázolódott. Plazmaferézist és szteroid-lökésterápiát indítottunk érdemi effektus nélkül. A szteroidterápia folytatása mellett iv. immunglobulint alkalmaztunk, a tünetek jelzett javulását észleltük. Azatioprin beállítását kezdtük el, ezt mellékhatások miatt elhagytuk. Tekintettel a betegség kórlefolyásában észlelt időszakos relapszusokra, rituximab alkalmazása mellett döntöttünk, ami tünetstabilizálódást, enyhe állapotjavulást eredményezett. Megbeszélés: Bár a GAD-asszociált cerebellaris ataxia lassú lefolyást mutató, krónikus betegség, a mihamarabbi diagnózis kulcsfontosságú. A gravis cerebellaris atrophia megelőzése, a cerebellaris rezerv lehetőség szerinti megtartása időben elkezdett, adekvát immunterápiával lehetséges. A diagnózist segíti a képalkotó vizsgálaton látott cerebellaris atrophia, illetve a gyakran társuló autoimmun kórképek ismerete. Összefoglalás: Fiatal, autoimmun társbetegségekben is szenvedő, két éve tünetes, anti-GAD cerebellaris ataxia miatt gondozott férfi betegünk státusza plazmaferézis, bolus szteroid, azatioprin, IVIG mellett érdemi javulást nem mutatott. Rituximab hatására állapota stabilizálódott, enyhe javulást sikerült elérnünk. Radiológiai követését a cerebellaris rezerv megítélése céljából MR-spektroszkópiával tervezzük.
Neuropszichiátriai lupus (NPSLE) bemutatása egy fiatal nő esete kapcsán
Bevezetés: Szisztémás lupus erythematosusban (SLE) az esetek 60%-ában észlelhetők idegrendszeri tünetek, melyek akár megelőzhetik, illetve kísérhetik vagy követhetik is a betegség diagnózisának felállítását. Az SLE-ben egyidejűleg jelentkező centrális és perifériás idegrendszeri tünetek differenciáldiagnosztikai kihívást jelenthetnek. Egy 23 éves nőbeteg kórtörténetén keresztül szeretnénk ismertetni a betegségben megjelenő neuropszichiátriai szövődményeket (NPSLE). Esetismertetés: Betegünk több hónapja fennálló, időnként jelentkező, 2-3 napig tartó fejfájás és enyhe kognitív zavar miatt jelentkezett neurológiai szakrendelésünkön. Felvételét megelőzően körülbelül 1 hónappal belgyógyászati osztályon kezelték mélyvénás thrombosis miatt, ekkor orális antikoaguláns terápia került beállításra. Az akutan elvégzett koponya-CT-vizsgálat (venográfia) panaszait magyarázó eltérést nem igazolt. Kezdetben migrénre gyanakodtunk, azonban a koponya-MRI-n látott elváltozások (microangiopathia, kisérvasculitisre utaló jelek) szisztémás autoimmun betegség lehetőségét vetették fel, ezért a beteget immunológiai centrumba utaltuk. Az ott elvégzett vizsgálatok – az érvényben lévő kritériumrendszer alapján – egyértelműen igazolták az SLE-t. A hetente 4 alkalommal alkalmazott chloroquinkezelés mellett a beteg állapota stabilizálódott, fejfájása, kognitív zavara megszűnt. Következtetés: Az általunk ismertetett – az ARC-kritériumok alapján is definitíven igazolt –, lupusban szen- vedő betegünk esete jól szemlélteti az SLE-ben elsőként megjelenő neuropszichiátriai tüneteket, és jó példa arra, hogy egy szisztémás autoimmun betegség szervi manifesztációjának tünetei akár meg is előzhetik a betegség diagnózisának felállítását.
Központi idegrendszeri vasculitis gyanújával vizsgált betegek vizsgálati eredményeinek retrospektív feldolgozása (OMIII, 2016–2021)
Bevezetés: A központi idegrendszeri (KIR) közép- és nagyérvasculitisek az intracranialis és nyaki artériák gyulladásával járó betegségek, melyek az érfal megvastagodása miatt az artériák szűkületét vagy elzáródását okozhatják. Ezen vasculitisek leggyakoribb tünete az agyi infarktus, az átmeneti agyi keringési zavar és a fejfájás. A primer KIR-vasculitis kizárólag az intracranialis ereket érinti, eredete ismeretlen. A szekunder KIR-vasculitisben az intracranialis erek gyulladása szisztémás kórkép (például SLE, HSV-fertőzés) részeként alakul ki. Célkitűzés: Az OMIII (korábban OKITI) Neurológiai Osztályán KIR-vasculitis iránydiagnózissal kezelt betegek vizsgálati eredményeinek feldolgozása a differenciáldiagnosztikai algoritmus pontosítása céljából. Módszerek: Az intézetünkben 2016. január és 2021. július között KIR-vasculitis gyanújával vizsgált 46 beteg vizsgálati eredményeinek statisztikai feldolgozása. Eredmények: Az akut stroke-ellátás során végzett CTA- és DSA-vizsgálat számos esetben felhívja a figyelmet KIR-i vasculitis lehetőségére. A pontos diagnózis felállításában segít a vasculitisprotokollal végzett koponya- MR- és MRA-vizsgálat. A megadott időszakban összesen 46 betegnél készült vasculitisprotokoll szerint MR- és MRA-vizsgálat. Az UH-val kimutatható halo-jel hasznos noninvazív kiegészítője a képalkotó vizsgálatoknak, ugyanakkor hiánya nem zárja ki a vasculitis lehetőségét. Pozitív halo-jel esetén végzett a. temporalis biopszia az esetek nagy részében alátámasztja a diagnózist. Hat betegnél (13%) láttunk egy vagy két oldali pozitív halo-jelet, ezek közül 3 betegnél lett pozitív a temporalis biopszia. Szérum- és liquorszerológiai vizsgálatok (szérum: HIV, HCV, HBV, VZV, HSV, Treponema pallidum, Borellia burgdorferi, liquor: HSV, VZV, Borellia) szükségesek a szekunder vasculitis kizárásához. A radiológiai vizsgálatok, a rutin labor- és a szerológiai vizsgálatok eredménye alapján 17 betegnél (37%) igazoltunk KIR-vasculitist; minden diagnosztizált beteg szteroid- vagy speciális immunterápiában (rituximab, MTX, cyclophosphamid) részesült. Összefoglalás: A központi idegrendszeri vasculitis lehetséges tünetei a stroke és a TIA-események. A betegség diagnosztizálása fontos, mert ezen betegek esetében a szekunder prevenciós módszerek (thrombocytaaggregáció- gátlás, antikoaguláció, lipidcsökkentés) nem elégségesek, a sikeres kezeléshez immunmoduláns terápia szükséges. A központi idegrendszeri vasculitisek diagnózisához körültekintő klinikai szemlélet szükséges, speciális eszközös vizsgálati módszerek és protokollok alkalmazásával.
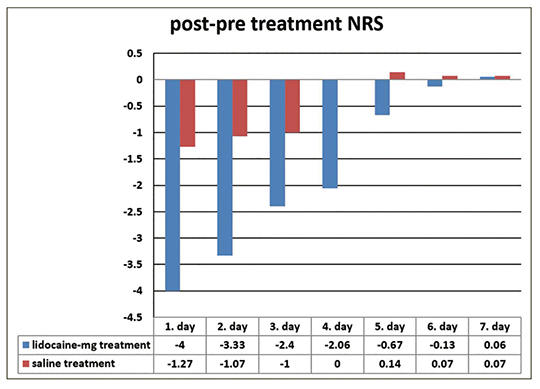
[Fájdalomcsillapító-túlhasználathoz társuló fejfájás kezelése intravénás lidokainnal és magnéziummal]
[A fájdalomcsillapító-túlhasználathoz társuló fejfájás kezelése során a detoxifikáció roppant kellemetlen a beteg számára. Vizsgálatunk célja az volt, hogy megállapítsuk az alacsony dózisú intravénás lidokain és magnézium (100 mg lidokain és 1,25 mg magnézium) kombinációjának hatékonyságát fájdalomcsillapító-túlhasználathoz társuló fejfájásban szenvedők detoxifikációjában. Összesen 30 beteget vontunk be a vizsgálatba; 15 beteg 24 óra időtartamú intravénás hidratációban részesült, 15 beteg 24 óra időtartamú intravénás hidratáció mellett a fájdalom kezdetekor 1 órás időtartamú lidokain-magnézium infúziót is kapott. Dokumentáltuk a fejfájás súlyosságát (numerikus fájdalomskála, NRS), időtartamát, kezdetét, a havi fájdalomcsillapító-fogyasztást és a havi fejfájásos napok számát. Egy héten keresztül értékeltük a két csoport fejfájássúlyosságát a napi kezelés előtt és után. A kezelés előtti NRS-értékekben nem volt szignifikáns különbség a két csoport között; az intravénás lidokain-magnézium infúziót kapó csoportban az első 5 nap során szignifikánsan csökkentek a kezelés utáni NRS-értékek (p < 0,05). Az 1 órás időtartamú, kombinált lidokain-magnézium infúzió elősegítheti, hogy a fájdalomcsillapító-túlhasználathoz társuló fejfájásban szenvedők detoxifikációja sikeresebb legyen: csökkenjen a fájdalom és a gyógyszerhasználat (neuroleptikumok, benzodiazepinek, antiemetikumok és opioidok használata), továbbá csökkenjen a kórházi tartózkodás hossza, valamint költsége. A kombinált használat során kevesebb mellékhatás jelentkezik, mint akkor, ha a szereket külön-külön alkalmazzuk.]
Koronavírus-betegség reumatológiai betegek körében – a megfertőződés, a súlyos lefolyás és a hatásos vakcináció esélyei
A gyulladásos és reumatológiai betegségekben szenvedők koronavírus-fertőzöttségének gyakorisága nem tér el jelentősen a helyi népesség fertőzöttségi arányaitól. A nagyobb adagú kortikoszteroiddal kezeltek, elsősorban a súlyosabb szisztémás autoimmun betegek megfertőződésének nagyobb a valószínűsége. A hospitalizáció, illetve a mortalitás esélye sem tér el lényegesen a népességi Covid-fertőzöttekétől. E tekintetben is kivételnek számítanak a nagyobb mennyiségű kortikoszteroidokkal és citosztatikumokkal kezeltek. A Covid-prognózist illetően az általában kockázatot jelentő társuló betegségek (a Covid előtti reumatológiai felmérések szerint) ugyanazok a gyulladásos és a nem gyulladásos reumatológiai betegek körében. Ezért nem a reumatológiai betegség miatt súlyos a Covid-kimenetel kockázata, hanem az időskor és az ebben az életkori csoportban egyaránt fellelhető cardiopulmonalis és anyagcsere-betegségek következtében. A gyulladásos reumatológiai/autoimmun betegek kezelésének fegyvertárából hipotetikus alapon a súlyos Covid kezelésére kiválasztott készítmények közül a dexamethason hatásossága bizonyított egyértelműen. Speciális betegcsoportokban kedvező hatása lehet az interleukin-6-antagonistáknak és a JAK-gátlóknak. A reumatológiai és az autoimmun betegségek kezelésére alkalmazott betegségmódosító gyógyszerek, köztük az antimetabolitok, az anticitokin immunológiai készítmények és a JAK-gátlók nem jelentenek Covid-kockázatot, adásukat nem kell megszakítani. Kivétel ez alól a korai B-sejteket közvetlenül elpusztító rituximabkészítmény, amely a súlyos kimenetel esélyét növeli a kezeltekben, feltehetően aktív betegségük és a gátolt humorális immunvédekezés miatt. A Covid-vakcináció szintúgy nem jelent speciális akut kockázatot reumatológiai és autoimmun betegek számára. Hosszabb távon még vizsgálandó, hogy az immunválasz erősségét és tartósságát reumatológiai betegekben a vakcináció speciálisan befolyásolja-e.
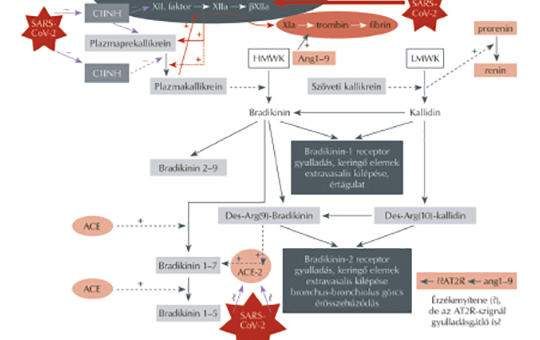
Bradikinin-citokin vihar és patomechanizmusa igen súlyos Covid-19-fertőzésben
A szerzők a súlyos, fékezhetetlen szisztémás gyulladásba, thromboticus folyamatokba torkolló Covid-19 patomechanizmusának hátterét, a fertőző koronavírus, a lokális celluláris-szöveti kontakt rendszer, a kinin-kallikrein és renin-angiotenzin rendszerek rendkívül komplex interakcióit tekintik át közleményükben. Kritikusan értékelik a súlyos Covid-19 hátterében a domináns bradikinin-citokin vihart fékező, lehetséges terápiás beavatkozásokat, amelyek támadáspontja a bradikininképződés mérséklése, bontásának elősegítése, a B2-receptor, vagy az indukált citokinválasz blokkolása.
RAAS-gátló kezelés – Covid-pandémia
A SARS-CoV-2 okozta különböző méretű és lefolyású akut légzési szindróma ma az egészségügyi rendszerek legnagyobb kihívása világszerte. A Covid-19 klinikai képének kialakulásában döntő szerepe van a renin-angiotenzin-aldoszteron, valamint a kinin-kallikrein rendszernek, illetve ezen rendszereken belül két endopeptidáznak, az ACE és ACE-2 enzimeknek. Az ACE által stimulált Ang II/AT1R tengely káros hatásait (oxidáns, gyulladáskeltő hatás, vasoconstrictio) az ACE-2 által indukált AT2R- és MasR-aktivitás (antioxidáns, gyulladáscsökkentő hatás, vasodilatatio) ellensúlyozza. A SARS-CoV-2 azért okoz ilyen súlyos tüdő- és szisztémás gyulladást, mert az ACE-2-t, mint a tüdő fontos védelmi tényezőjét, károsítja a SARS-CoV-2 fehérjetüskéje az ACE-2-höz kötődéssel, ami az ACE-2-szint csökkenéséhez vezet. Ezzel párhuzamosan fokozott a bradikinintermelődés, amely a BKB1- és BKB2-receptorok révén ugyancsak erősíti a SARS-CoV-2 gerjesztette citokinvihart. Mivel a RAAS-gátló szerek (ACEI, ARB) különböző támadási helyeken és különböző mértékben befolyásolják a két említett szabályozó rendszert és enzimeket, sürgős volt szerepük tisztázása a Covid-fertőzés során, hiszen alkalmazásuk igen kiterjedt és nélkülözhetetlen pillére számos népbetegségnek (hypertonia, cardiorenalis anyagcsere-betegségek). A patofiziológiai és kísérletes adatok alapján jogosan feltételezhető, hogy Covid-fertőzésben a társbetegségekkel járó esetekben – kifejezetten az idős egyéneknél – a csökkent ACE-2-expressziót a RAAS-gátlók helyreállíthatják, és újra érvényesülni tud az elmaradt, vagy csökkent védőhatás. Ez a védőhatás mindkét RAAS-gátlóra érvényes. A klinikai vizsgálatok egyértelműen alátámasztják a különböző nemzetközi társaságok deklarált véleményét, miszerint a RAAS-gátlók alkalmazása nem növeli a Covid-19-előfordulást, illetve a súlyos, kritikus Covid-betegek megjelenésének kockázatát. Ennek értelmében az elindított RAAS-gátló kezelést folytatni lehet és szükséges a Covid-19 betegség kialakulása folyamán.
Klinikum
2021. SZEPTEMBER 09.
Klinikai vizsgálatokról
A klinikai vizsgálatok célja megtalálni a betegségek megelőzésének, diagnosztikájának vagy kezelésének megfelelő módját. A kezelést tekintve a klinikai vizsgálatok célja gyakran annak megállapítása, hogy az új kezelés hatásosabb és kevesebb mellékhatással jár, mint más, már a gyakorlatban használt eljárás. A klinikai vizsgálatokat a félig-kísérletek közé sorolják és akár több vizsgálat együttes kiértékelésére is szükség lehet az eredmények általánosításához (metaanalízis, evidence synthesis).
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.