Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 429
A nem alkoholos zsírmájbetegség
A nem alkoholos zsírmájbetegség becslések szerint az emberiség 25%-át érinti, gyakran társul más anyagcserezavarokkal és nagymértékben heterogén a lefolyása. Steatosis formájában csekély a súlyosabb májkárosodás valószínűsége, míg a steatohepatitisszel járó esetek harmada cirrhosis felé halad, és súlyos szövődményként primer májrák kialakulásához is vezethet. Ennek valószínűsége együtt növekszik a májfibrosis mértékével, valamint a 2-es típusú cukorbetegség, esetleg két vagy több anyagcsere-rizikófaktor jelenléte esetén. A betegség azonban, a májkárosodás súlyosságától függetlenül, fokozza a cardiovascularis betegségek, a diabetes és a malignus daganatok iránti fogékonyságot, és ennek megfelelően rövidíti a várható élettartamot. Mindezek ellenére az egészségügyi szakemberek és betegek ismeretei a kórképpel kapcsolatosan meglehetősen korlátozottak. Ebben valószínűleg szerepet játszik az is, hogy a nem alkoholos zsírmájbetegségnek egyelőre nincs általánosan elfogadott gyógyszeres terápiája. Tekintve, hogy a betegség alapvető oka leggyakrabban a kalóriatöbblet, az elsődleges kezelés lényege az életmód-változtatás, a mediterrán diéta, az alkoholfogyasztás kerülése és a rendszeres fizikai aktivitás. Szélesebb körű ismeretterjesztés segítheti mindennek felismerését és elfogadását az alapellátásban, párhuzamosan a májfibrosis kétlépcsős szűrésének bevezetésével, amely a fokozott rizikójú betegek hatékony felismerését és ellátását célozza.
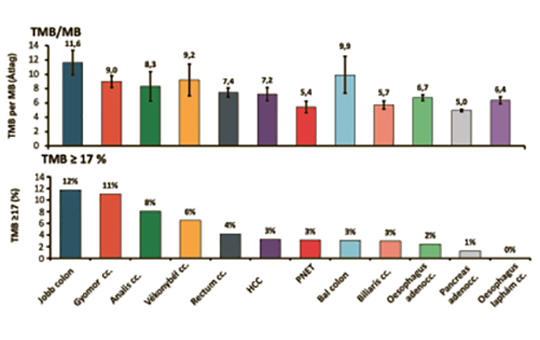
Biomarkerek szerepe a gastrointestinalis daganatok kezelésében
Összefoglaló – A komprehenzív molekuláris profilvizsgálatokon, a bioinformatika fejlődésén alapuló precíziós onkológiai megközelítés, célzott terápia és immunellenőrzőpont-inhibitorok (immune checkpoint inhibitors – ICI) gyökeresen változtatta meg az onkoterápia eredményeit. Az előrehaladott, metasztatikus stádiumú emésztőrendszeri daganatokban szenvedő betegek kedvezőtlen túlélési esélye jelentősen javult az új terápiás lehetőségek alkalmazásától. A sikeres terápia azonban számos molekuláris jellemző ismeretét, meghatározását igényli – PD-L1 expresszió, MSI (mikroszatellita-instabilitás)/dMMR (mismatch repair deficiency), TMB (tumor mutational burden), rezisztenciamutációk, genetikai variánsok jelenléte. Jelen összefoglaló célja áttekintést adni a gastrointestinalis (GI) traktus rosszindulatú daganatainak precíziós onkológiai szemléletű kezelésében alkalmazható prediktív és prognosztikus biomarkerek szerepéről, jelentőségéről.
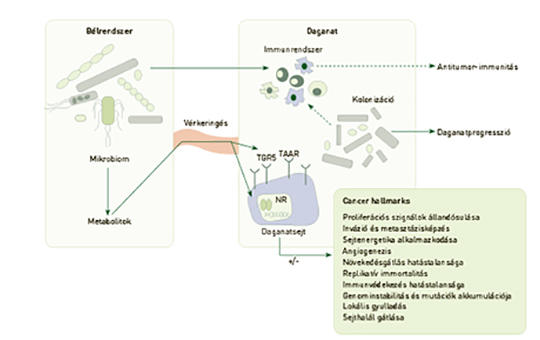
A mikrobiom és a rák
Az emberi szervezet legtöbb szerve és kompartmentje nem steril, ezekben új generációs szekvenálási eljárásokkal bakteriális DNS vagy RNS mutatható ki. Az egy adott kompartmentben kimutatható baktérium örökítőanyag összességét metagenomnak, a transzkriptek összességét metatranszkriptomnak, a baktériumok összességét pedig mikrobiomnak nevezzük. A mikrobiom összetétele megváltozik neoplasztikus betegségekben, amit onkobiózisnak nevezünk, az így kialakult fajösszetételt pedig onkobiomnak. A daganatok jelentős része kolonizálódik, és a daganatokban található baktériumok elősegítik a daganat növekedését, illetve fejlődését. A daganattól távoli kompartmentek (például bél) is áteshetnek onkobiotikus transzformáción. A bélmikrobiom onkobiotikus transzformációja során csökken a bélmikrobiom metabolikus kapacitása és több citosztatikus bakteriális metabolit szintézise lecsökken, ami a daganatsejtek proliferációjához és a metasztázisok képződéséhez vezet. A bélmikrobiom immunológiai tulajdonságai alapvetően meghatározzák azt, hogy az immunrendszer mennyiben tolerogén a daganatsejtekkel szemben, így elsődleges a daganatimmunitás szempontjából. Az onkobiózis önmagában nem indukál daganatokat, azonban elősegítheti növekedésüket és metasztázisképző képességüket. A baktériumoknak fontos szerepe van az antineoplasztikus terápia sikerességében, illetve a mellékhatások kialakításában.
Magyarországon minden nyolcadik nőnél diagnosztizálnak emlődaganatot– a digitális egészségügyi fejlesztések új korszakot nyithatnak a mellrák diagnosztikájában és kezelésében
Magyarországon egy a nyolchoz az esélye, hogy egy nőt az élete során mellrákkal diagnosztizáljanak. Nagyon fontos a megelőzés, a kétévenkénti rákszűrés, hiszen az emlőrák a nőknél a leggyakoribb daganat. Magyarországon évente 7500 új esetet diagnosztizálnak, és 2000 nő hal meg mellrákban. Az emlődaganatok kezelésében is egyre nagyobb teret kapnak a személyre szabott, célzott terápiák. Az Oncompass Medicine tudományos igazgatója, dr. Peták István és csapata egy olyan mesterséges intelligencia (MI) alapú eszközt - kalkulátorszoftvert – fejlesztett ki, ami az orvosoknak segít kiválasztani a leghatékonyabb célzott kezelést a beteg számára.
Angiogenezis-gátlók és immunjelátviteli pontokra ható szerek kombinációja egymás hatásának potencírozására
A daganatok nem sebészi kezelésében mind az angiogenezis gátlásának, mind az immunfolyamatok befolyásolásának jelentős és egyre növekvő szerepe van. A tumoros neo-angiogenezis kedvezőtlenül befolyásolja az immunrendszer működését, ezért gátlása serkenti a kulcsfontosságú T-lymphocyták és azok működését támogató egyéb tényezők hatását, kedvezően befolyásolja a daganat mikrokörnyezetét, miközben az immunjelátviteli pontokra ható kezelés segít az érrendszer normalizálásában. A két támadáspont együttes befolyásolása ezért kedvező hatású lehet. A szerzők vesesejtes rákban, melanoma malignumban, nem kissejtes tüdőrákban, vastag- és végbél-, valamint hepatocellularis és emlőrákban mutatják be a két hatásmechanizmusú csoportba tartozó szerek alkalmazását és kombinálását, megállapítva, hogy sikerrel zárult fázis III vizsgálatok döntően a világos sejtes (vagy világos sejtes komponenst is tartalmazó) vesesejtes rákokban történtek. Hangsúlyozzák, hogy az immunterápiához általában szükséges az érzékenységet előrevetítő paraméterek (megfelelő PD-L1, MSI-H, dMMR, TMB-H) kimutatása, és a tumoragnosztikus kezelés terápiás filozófiája mellett is figyelembe kell venni a törzskönyvezett javallatokat.
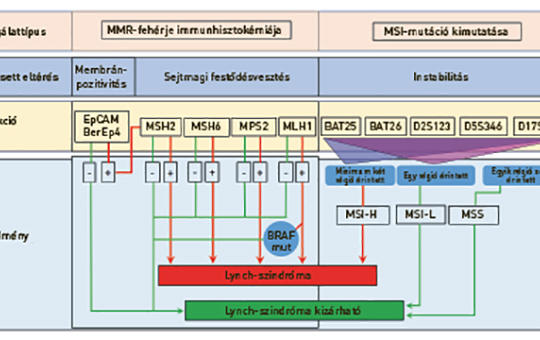
Mikroszatelliták mint a genom „szeizmográfjai”
A genetikai állomány fehérjét nem kódoló, monotonon ismétlődő, 1–6 nukleotidot tartalmazó szakaszain, a mikroszatellitákon a DNS-kettőződésért felelős polimerázok könnyen hibáznak. Így azok rövidülnek vagy hosszabbak lesznek. Ha az ilyen típusú DNS-hibákat javító enzimek működőképesek, a mutációk kijavítódnak. Ha nem, akkor különböző hosszúságú szakaszokként, instabil formában adódnak át az utódsejtekbe. Nemcsak korán jelzik a fokozott mutációs hajlamot, hanem önmagukban is, keretleolvasási problémát okozva, továbbiakat generálnak. Következésképpen a mikroszatellita-instabil (MSI) daganatok nagyobb arányban fejeznek ki idegen antigéneket, mint ezen eltérést nem mutatók, ami a tumorellenes immunválasz fokozott hatékonyságát valószínűsíti. Az MSI tehát nemcsak a genetikai instabilitásra, hanem az immunellenőrzőpont-gátló szerek hatásosságára is utal. Jelenlétét lehet közvetlenül, nukleotidfelbontási szintű PCR-alapú eljárással vagy közvetve, a hibajavító fehérjék kimutatásával, immunhisztokémiával vizsgálni, de ma már új generációs szekvenálási adatokból és mesterséges intelligencia képi elemzésből is kinyerhetők ilyen információk. Az MSI-meghatározás módszertanát és klinikai jelentőségét foglaljuk össze.
Sugárterápia indukálta másodlagos daganatok
Az onkológiai kezelések szerves részét képezi a sugárterápia, amiben a betegek közel fele részesül. A modern onkológiai kezeléseknek köszönhetően a túlélés egyre hosszabb, így a betegek körülbelül egyötöde megéli azt is, hogy egy második tumor kialakuljon. Több tanulmány szerint maga az onkológiai kezelés is összefüggésbe hozható a másodlagos primer tumor kialakulásával, ami egyes becslések szerint az esetek 5-8%-ában lehet a sugárterápia következménye. Nagy kihívást jelent, hogy megértsük a sugárterápia okozta hatásokat az esetlegesen túlélő daganatsejtekben, a daganatot körülölelő egészséges szövetekben, az alacsony dózisban részesült területekben, illetve az egyáltalán nem irradiált szövetekben, ahol abszkopális hatások érvényesülhetnek. Ezek együttes hatása tehető felelőssé az úgynevezett radiokarcinogenezis kialakulásáért. Manapság számos tanulmány foglalkozik a sugárterápia daganatindukáló hatásaival. Ez az összefoglaló arra hivatott, hogy áttekintse a témával kapcsolatos ismereteinket a patogenezis, radiogenomikai, sugárfizikai és sugárbiológiai szempontok alapján, továbbá tárgyalja a megelőzés és a szűrés lehetőségeit. A sugárterápia kétélű fegyver, amely egyrészt nagyon jól alkalmazható a daganatos betegségek kuratív kezelésében, másrészt azonban potencionálisan másodlagos daganatot indukálhat, amely évekkel később jelentkezik. Emiatt a jövőben a maximálisan optimalizált, személyre szabott sugárterápiának lehet csak létjogosultsága.
A daganatos elváltozások hatékony diagnosztikáját segítő labort alakítottak ki Szegeden
A daganatos elváltozások hatékony diagnosztikáját segítő laboratóriumot alakítottak ki uniós támogatással a Szegedi Tudományegyetem (SZTE) patológiai intézetében – tájékoztatta a felsőoktatási intézmény közkapcsolati igazgatósága az MTI-t.
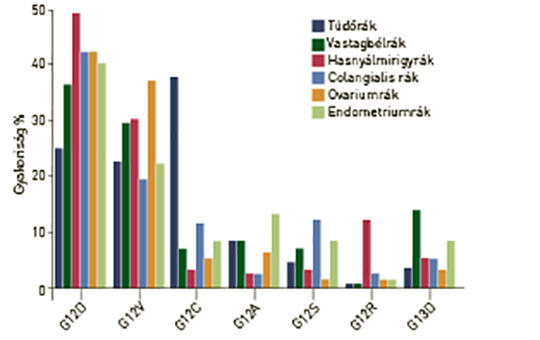
A (K)RAS-mutáció molekuláris epidemiológiája emberi daganatokban
A RAS onkogén mutációja a leggyakoribb génhiba emberi daganatokban, és a három családtag közül a K-RAS-é a leggyakoribb, amit az N-RAS követ. A tipikus K-RAS-mutáns daganatok a hasnyálmirigyrák, vastagbélrák és tüdő-adenocarcinoma, amelyekben a mutáns variáns allélok gyakorisága igen heterogén, aminek hátterében eltérő karcinogenezis áll. A RAS-mutáns daganatok genetikai sokszínűségét tovább fokozza, hogy a mutáns allél homo- vagy heterozigóta formában van-e jelen. A sokszínűség egy másik forrása az, hogy a különféle daganatokban a K-RAS-mutánsok esetében sajátos kísérő mutációs mintázatú altípusok lehetnek. Mindezeknek az a következménye, hogy a K-RAS-mutáns daganatok biológiai viselkedése és nagy valószínűséggel terápiás érzékenysége is nagyon heterogén lehet. A K-RAS-inhibitorok klinikai debütálásával ezeknek a kérdéseknek egyre nagyobb jelentősége lesz.
A méhnyakrák korszerű onkológiai kezelése
Világszerte évente több mint félmillió nőnél igazolódik méhnyakrák, és körülbelül 300 000 halálesetet okoz a betegség. A nyugati társadalmakban a cervixcarcinoma incidenciája és mortalitása csökken a humán papilloma vírus (HPV) elleni vakcinációnak és a populációs szintű szűrésnek köszönhetően. A fejlődő világ országaiban azonban továbbra is emelkedő a tendencia. A rákmegelőző állapotok és a korai méhnyakrák definitív onkológiai ellátása a stádiumfüggő kiterjesztéssel végzett műtétek révén lehetséges. A posztoperatív sugárkezelés vagy kemoradioterápia szükségessége a patológiai rizikófaktorok alapján határozható meg. Előrehaladott méhnyakrákban a definitív kemoradioterápia vagy a szisztémás kezelés a terápiás alternatívák. A fiatal betegek részéről gyakran felmerülő kívánság a fertilitásmegtartás, amely az onkológiai elvekkel csak jól definiált határok között egyeztethető össze, alapos felvilágosítást követően. A terhesség alatt felismert méhnyakrák becsült incidenciája 1,4-4,6 eset/100 000 szülés, amelynek ellátása során, az onkológiai szempontokon túl, a magzat biztonságát is szem előtt kell tartanunk az anya preferenciái alapján. A klasszikus kemoterápia mellett a biológiai szerek is megjelentek a közelmúltban a méhnyakrák szisztémás kezelési lehetőségei között: első vonalban bevacizumabbal egészíthető ki a ciszplatin-paclitaxel kombináció közel négy hónapos túlélési előnyt nyújtva a betegek számára; míg másodvonalban pembrolizumab adható mikroszatellita-instabil vagy PDL-1-et expresszáló (combined positive score [CPS] ≥1), illetve magas tumormutációs terheltséget (TMB ≥10) mutató daganatok esetén. A jelen munka egy rövid összefoglalót szolgáltat a méhnyakrák megelőzéséről, kivizsgálásáról és onkológiai ellátásáról.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.