Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 394
Egészségpolitika
2021. FEBRUÁR 05.
Vége a TVK 16 éves uralmának – újraszabták a kórházi finanszírozást
A teljesítmény-volumenkorlát elve szerinti számolás tizenhét év után megszűnik a szakellátásban.Bevezetik az éves keretet a finanszírozásban, illetve szakmákra lesz kiosztva ez a pénz. Az idén életbe lépett változás megkérdezett szakértőink szerint leginkább átnevezés, de nem jelent átütő változást. Igaz, várhatóan megszűnik a kórházak mozgástere abban, hogy a jól és kevésbé jól fizetett területek között „játszanak”.
A méh rosszindulatú daganatainak korszerű onkológiai kezelése
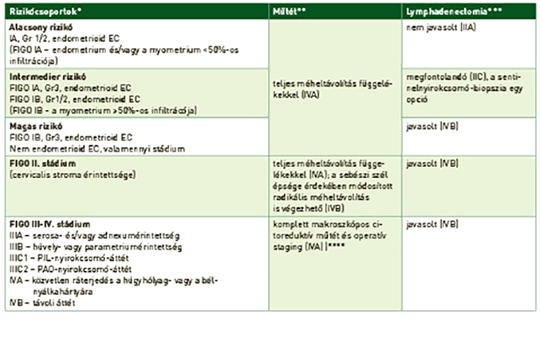
Világviszonylatban évente közel 400 000 nőnél igazolódik méhtestrák, amely 2018-ban körülbelül 90 000 nő halálát okozta. Az esetek túlnyomó részét a méhnyálkahártya hormonérzékeny hámjából kiinduló endometriumcarcinomák (EC) alkotják. A sarcomák a méhtestrákok alig 3%-át adják. Az EC-k 80-85%-a jó prognózisú, mivel alacsony gradusú és korai stádiumban kerül felismerésre, amikor a műtét és az esetleges posztoperatív kezelés révén a gyógyulás reális terápiás cél. Az előrehaladott stádiumban diagnosztizált EC és a nem endometrioid altípusok esetén a prognózis lényegesen rosszabb. A magas rizikójú EC optimális adjuváns kezelésére irányuló vizsgálatok egy része még folyamatban van, illetve a bővülő molekuláris ismeretek újabb vizsgálatokat generálnak. A méhtestsarcomák esetében is a sebészi eltávolítás jelenthet kuratív megoldást, az adjuváns kezelésre vonatkozó evidenciák bizonytalanok, egyéni mérlegelést igényelnek. A modern onkoterápia érájában már nemcsak a betegségmentes élet meghosszabbítására, hanem az élet minőségének minél teljesebb megőrzésére is törekszünk. A nőgyógyászati onkológiában ezt jelenti a fertilitás vagy a funkcionáló ováriumok lehetőség szerinti megőrzése; a magas morbiditással járó szisztémás lymphadenectomia indikációs körének szűkítése; a kedvezőbb mellékhatásprofilú brachytherapia alkalmazása a teljes kismedencei besugárzás helyett. A modern onkoterápia az úgynevezett biológiai kezelések által az előrehaladott betegségek ellátásának is a részévé vált: kemoterápia mellett/után progrediáló esetekben a pembrolizumab az EC és a sarcomák esetén is alkalmazható mikroszatellita-instabilitás vagy magas tumormutációs terheltség esetén, míg az NTRK fúziós gén jelenlétében larotrectinib vagy entrectinib mint célzott tirozinkináz-gátlók javasolhatók. Az EC-k 70-80%-át kitevő mikroszatellita-stabil esetekben (nem endometrioid altípusokban is!) a pembrolizumab lenvatinibbel kombinációban adható a kemoterápia után. Az EC területén gyarapodnak továbbá az egyéb célzott terápiás szerekkel szerzett tapasztalatok is (anti-HER2 serosus carcinomában, mTOR-gátló kezelés, endokrin terápia, más immun checkpoint inhibitorok, tirozinkináz-gátlók, PARP-gátlók és kombinációs kezelések). A jelen munka a méhtestrákok onkoterápiájáról kíván rövid összefoglalást nyújtani az aktuális szakmai ajánlások és a folyamatban lévő vizsgálatok bemutatásával.
Agnosztikus terápia onkológiai alkalmazása
A tumoragnosztikus terápia az onkológiai kezelés ígéretes lehetősége, azonban a potenciális célpontok klasszifikálása, validálása, azok egységes módszerek szerinti kimutatása elengedhetetlen. A tumoragnosztikus kezelések engedélyezése új típusú, biomarker-vezérelt klinikai vizsgálatok bevezetését tette szükségessé. Jelenleg három tumoragnosztikus molekuláris célpont ismert: a daganatok magas fokú mikroszatellita-instabilitása (MSI-H), a neurotrop-tirozinkináz-receptor (NTKR) gének fúziója, valamint a daganatok magas tumormutációs terhelése (TMB-H). A pembrolizumab (anti-PD-1 antitest) az első tumoragnosztikus indikációban is törzskönyvezett gyógyszer, amelyet először MSI-H daganatok kezelésére engedélyeztek, majd később a magas TMB is bekerült az indikációk közé. Az NTKR-fúziót hordozó daganatok kezelésére a larotrectinib és az entrectinib került engedélyezésre.
Az immunválasz néhány újonnan felismert hatásmechanizmusa és az immunológia szemléleti átalakulása
Az immunológia az egészséges és kóros immunválaszt tanulmányozó komplex tudomány. Ez az élettani, patofiziológiai tudományág az egyes mechanizmusok megértését elsősorban sejt- és molekuláris biológiai, genetikai, epigenetikai és (neuro)endokrinológiai megközelítéssel, illetve a patológiás folyamatok részleteinek feltárásával végzi. Az immunológia egyike a nagyon gyorsan fejlődő tudományoknak, eredményei visszahatnak más diszciplínákra is elméleti (például hálózattudományok, rendszer-biológia) és módszertani (monoklonális ellenanyagok, biomarkerek, immunoassay-ek) szinten egyaránt. Az immunológusok az elmúlt évtizedekben számos szemléleti változást értek meg, és sok, a hatásmechanizmusokban megnyilvánuló lényegi részletkérdés érvényesülését ismerték fel.
Az idegtudományi kutatások új eredményeinek tanulságai – a mentális zavarok tünettani és etiológiai heterogenitásának háttértényezői
Napjainkban a genetikai, neurobiológiai, neuropszichológiai és pszichoszociális kutatások középpontjában a pszichiátriai betegségek etiológiájának pontosabb felderítése áll, különös tekintettel az egyes rizikófaktorok szerepére és komplex interakcióira. Azonban egyre nagyobb kihívást jelent az eltérő szempontú és módszerű kutatások eredményeinek koherens elméleti keretben való értelmezése, pedig csak ez vezethet a pszichiátriai betegségek komplexitásának és kialakulásuk mechanizmusának pontosabb megértéséhez. A közlemény célja a mentális zavarok etiológiai hátterével kapcsolatos új kutatási irányvonalak áttekintése, valamint az ezek integrálása érdekében kidolgozott Research Domain Criteria (RDoC) rendszer bemutatása. A legrangosabb pszichiátriai szaklapokban az elmúlt öt évben megjelent nagy esetszámú kutatásokról beszámoló közlemények áttekintése, melyek a mentális zavarok etiológiájával kapcsolatos új eredményeket foglalták össze. Bár a jelenlegi osztályozás szerint a mentális zavarok szigorúan elkülönített diagnosztikus kategóriákat alkotnak, az új eredmények arra utalnak, hogy ezek a markáns különbségek a tünettani, genetikai és neurobiológiai háttér vonatkozásában nem észlelhetők, hiszen kiderült, hogy számos mentális zavar hátterében közös molekuláris genetikai rizikófaktorok vannak, melyek közös neurobiológiai patomechanizmusokra utalhatnak. A kutatási eredmények a pszichiátriai nozológia etiológiai alapokon történő újragondolásának szükségességét támasztják alá, és fontos előrelépést jelentenek a mentális zavarok neurobiológiai háttértényezőinek pontosabb felderítésében és így a célzottabb terápiás módszerek kifejlesztésében is. Ebben komoly segítséget jelenthet az RDoC szempontrendszerének kidolgozása, hiszen ez a dimenzionális megközelítés annak esélyét nyújtja, hogy a – napjainkban még sokszor diffúz vagy akár ellentmondásos – idegtudományi kutatási eredményeket egységes elméleti keretbe integrálva a mentális zavarok etiológiájának, nozológiájának és terápiájának új aspektusai is megismerhetőek legyenek.
[TLR4- (Toll-like recetor-4-) expresszió és a frontocingularis régió térfogata szkizofréniában]
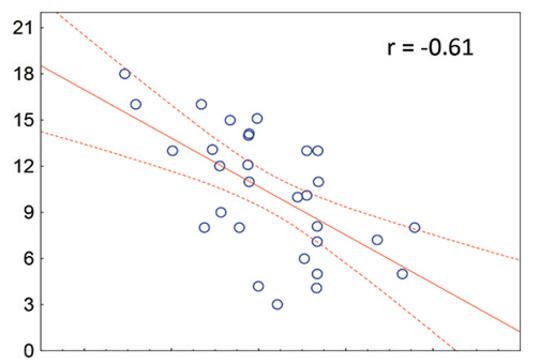
[Egyes patogénhez asszociált molekuláris mintázatfelismerő receptorok (Toll-like receptors, TLR) szerepet játszhatnak a szkizofrénia patogenezisében. Ezek a receptorok nemcsak a perifériás immunválaszban, de a neuroplaszticitás szabályozásában is fontosak. Ennek ellenére a perifériás TLR-expresszió és a szkizofréniára jellemző strukturális agyi eltérések közötti összefüggés nem ismert. A kérdés megválaszolására vizsgálatunkba 30 gyógyszermentes, első pszichotikus epizódját átélő szkizofrén beteget vontunk be. A TLR4+/TLR1+ monocytákat áramlási citometria segítségével detektáltuk. A résztvevőkről nagy felbontású agyi strukturális mágnesesrezonancia-felvételeket (T1 MR) készítettünk, amelyeket FreeSurfer szoftver segítségével értékeltünk ki, meghatározva a regionális agyi térfogatértékeket. Eredményeink szerint szignifikáns negatív korreláció mutatkozott a TLR4+ monocyták százalékos megoszlása és átlagos fluoreszcens intenzitása, valamint a frontális területek és az anterior cingulum térfogata között. Hasonló összefüggést TLR1+ monocyták esetében nem találtunk. Az eredmények felvetik annak a lehetőségét, hogy a kóros TLR-aktiváció hozzájárul a szkizofréniára jellemző regionális agyi térfogatcsökkenéshez.]
A humán immunrendszer rendszerelvű megközelítése
A nukleotidpolimorfizmusok kutatása révén kiderült, hogy az autoimmun betegségek kialakulásában nagyon kis hatáserősséggel nagyon sok genetikai lokusz közreműködik, és itt is kiderült, hogy egy-egy kórkép molekuláris heterogenitása – pl. SLE esetén – milyen óriási. E betegségek kezelését forradalmasította a biologikumok rendszerimmunológiának köszönhető bevezetése.
A sarcopenia – izomfogyás – patomechanizmusa, klinikai képe és metabolikus társbetegségei
A sarcopenia, vagy időskori izomerő- és izomtömeg-csökkenés napjaink demográfiai változásainak, azaz a hosszabb élettartam miatt az idősebb korosztály nagyobb számának köszönhetően is igen komoly népegészségügyi probléma. Az életkor előrehaladtával az izomszövet fokozatosan leépül, a folyamat eredményeként pedig csökken az izom tömege és ereje. Ezt az állapotot nevezzük sarcopeniának. A sarcopenia az izomtömeg, az izomerő és a funkcionális függetlenség egyidejű csökkenése. Ezzel párhuzamosan a fizikai teljesítmény romlik (gyengeség, lassúság, egyensúlyvesztés). Ezek halmozódó hiányok, következményük a fáradtság, az öregviselkedés, a fogyás. Többnyire szellemi hanyatlással jár, és fokozódó elszigetelődéshez vezet. A sarcopenia elsődleges formája az izomsejtek energiatermelésének csökkenése, majd az életkorral arányos pusztulása. Másodlagosan a hormonális kiesések, az idegrendszer betegségei, a kevés mozgás, a tápanyagok felszívódásának zavarai, éhezés, idült fertőzés gyorsítja ezt a folyamatot és súlyosbítja az érintett állapotát. A sarcopenia kialakulásában összetett genetikai, biokémiai, hormonális mechanizmusok vesznek részt. Involúciós folyamat, amelyben az izomzatot felépítő tényezők és a lebontás egyensúlya megbomlik. A sarcopeniás állapot kockázatainak felismerésére, szűrésére és kórismézésére kérdőívet és algoritmust dolgoztak ki, amely konkrét határértékek mentén választja el a sarcopeniásokat a nem sarcopeniásoktól. A 65 év felettiek járásának sebessége, a kezek szorítóereje és a mért vagy számított izomtömeg azok a vágáspontok, amelyek alapján a sarcopenia kimondható. A sarcopenia addig tekinthető az „élettani” öregedés részének és azután válik betegséggé, amikor a diagnosztikus határértékek átlépésekor az érintett által megélt funkcionális akadályok és az életminőség romlása bekövetkezik. A sarcopenia megelőzése és kezelése, az elesés kockázatának csökkentése a rendszeres erőkifejtést igénylő aktív tornagyakorlatok és mozgáskoordinácós gyakorlatok végzésén alapul. A gyógyszeres kezelés lehetőségei korlátozottak, a kínálkozó molekuláris terápiás célpontok ellenére nincs a látóhatáron meggyőzően hatásos innovatív terápiás eszköz. A mozgásterápia mellett az izomfejlődést serkentő aminosavak, így a leucin, illetve a β-hidroxi-metilbutirát analógja alkalmazásának hatásossága mellett szólnak gyenge bizonyítékok.
Táplálkozási ajánlások a CoVID-19 miatti karantén idején
A karanténhoz társuló stressz alvászavarokat is okozhat, ami tovább fokozhatja a stresszt és ezáltal a táplálékbevitelt, ami egy ördögi kör kialakulásához vezethet. Fontos, hogy vacsorára olyan ételeket fogyasszunk, amelyek szerotonint vagy melatonint tartalmaznak vagy elősegítik ezeknek a szintézisét.
Koronavírus-vilagjárvany – Új kihívások az onkoterápiában
Az állatokat fertőző koronavírusokkal kapcsolatos néhány alapvető megfigyelés felvázolását követően a szerző ismerteti – dióhéjban – az embereket fertőző alacsony és magas patogenitású koronavírusokat és az általuk okozott megbetegedéseket, különös tekintettel a Covid-19-koronavírus-betegséget okozó SARS-CoV-2 sajátosságaira és a fertőzöttek egy részénél fellépő súlyos akut respiratorikus szindróma (SARS) és többszervi elégtelenség patomechanizmusára. Ismerteti továbbá a világjárványt okozó SARS-CoV-2 és az ugyancsak súlyos alsó légúti tüneteket előidéző, magas patogenitású, de jóval kevesebb embert fertőző humán koronavírusok (SARS-CoV-1, MERS-CoV) között fennálló, emberről emberre való terjedésüket is befolyásoló, molekuláris szintű eltéréseket. Az áttekintés végén röviden érinti a SARS-CoV-2 fertőzés elleni aktív immunizálást biztosító vakcina, illetve a vírus replikációját szelektíven gátló gyógyszerek fejlesztésének kérdéseit és a SARS-CoV-2 fertőzött daganatos betegek kezelésével kapcsolatos ajánlásokat.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.