Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 361
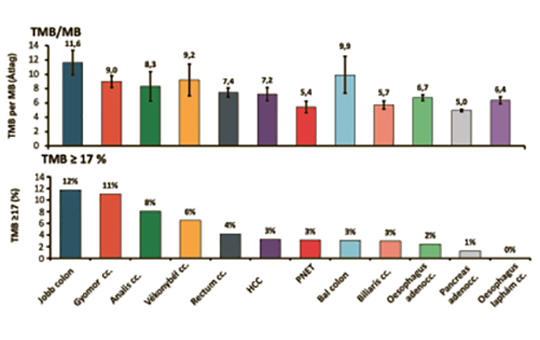
Biomarkerek szerepe a gastrointestinalis daganatok kezelésében
Összefoglaló – A komprehenzív molekuláris profilvizsgálatokon, a bioinformatika fejlődésén alapuló precíziós onkológiai megközelítés, célzott terápia és immunellenőrzőpont-inhibitorok (immune checkpoint inhibitors – ICI) gyökeresen változtatta meg az onkoterápia eredményeit. Az előrehaladott, metasztatikus stádiumú emésztőrendszeri daganatokban szenvedő betegek kedvezőtlen túlélési esélye jelentősen javult az új terápiás lehetőségek alkalmazásától. A sikeres terápia azonban számos molekuláris jellemző ismeretét, meghatározását igényli – PD-L1 expresszió, MSI (mikroszatellita-instabilitás)/dMMR (mismatch repair deficiency), TMB (tumor mutational burden), rezisztenciamutációk, genetikai variánsok jelenléte. Jelen összefoglaló célja áttekintést adni a gastrointestinalis (GI) traktus rosszindulatú daganatainak precíziós onkológiai szemléletű kezelésében alkalmazható prediktív és prognosztikus biomarkerek szerepéről, jelentőségéről.
Két dihidroorotát-dehidrogenáz (DHODH) gátló, a leflunomid és a teriflunomid hatásossága és biztonságossága Covid-19 esetén: narratív összefoglaló
A Covid-19-világjárványt okozó SARS-CoV-2 vírus és a gazdaszervezet interakciója egyre pontosabb részleteiben válik ismertté. Ezek alapján a preventív módon működő vakcinák fejlesztése mellett különféle támadáspontokon ható terápiás szerek előállítása és klinikai vizsgálata is folyamatban van. Egy ilyen gyógyszercsoportot jelentenek a dihidroorotát-dehidrogenáz (DHODH) gátlók, amelyek képviselői a leflunomid, illetve ennek aktív metabolitja, a teriflunomid. Kaur és munkatársai a Europen Journal of Pharmacology-ban megjelent cikkükben a DHODH-gátlók antivirális hatásmechanizmusát, biztonságosságuk és hatásosságuk bizonyítékait és lehetséges szerepüket a Covid-19 kezelésében mutatják be.
Idegtudományok
2021. NOVEMBER 11.
A hosszú távú fluoxetinkezelés alapvetően megváltoztatja az agyi lipidösszetételt
A hosszú távú fluoxetinhasználat feltételezhető agyfejlődési zavart okozó hatásának mechanizmusát próbálták kideríteni német és orosz kutatók fiatal majmokat vizsgálva. Az International Journal of Molecular Sciences című szaklapban megjelent kutatás eredménye szerint a hosszú távú fluoxetinkezelés több mint százféle lipid agyi mennyiségének szignifikáns változásával jár együtt, különösen jelentős az idegsejtnyúlványok myelinisatiójában központi szerepet játszó, többszörösen telítetlen zsírsavak mennyiségének csökkenése. A többszörösen telítetlen zsírsavak anyagcseréjének változása azért is különös figyelmet érdemel, mert a közelmúltban kiderült: ezek a molekulák, illetve hiányuk szerepet játszik a pszichiátriai betegségek, a bipoláris és major depresszív kórkép, valamint a szkizofrénia patogenezisében.
Idegtudományok
2021. OKTÓBER 11.
Dexamethason krónikus subduralis haematomában
A krónikus subduralis haematoma egy gyakori, főleg idősekben előforduló neurológiai kórkép, melyet a subduralis térben vér és bomlástermékeinek idővel elfolyósodó jelenléte jellemez. A kiváltó esemény gyakran kisebb fejtrauma, de a vérzés mechanikus hatásain túl a bekövetkező gyulladásos válaszreakció is szerepet játszhat a tünetek kialakulásában. A krónikus subduralis haematoma incidenciája emelkedést mutat a népesség elöregedésének és az antikoaguláns, valamint a vérlemezkegátló gyógyszerek egyre gyakoribb használatának következményeként. Előrejelzések szerint 2030-ra az USA-ban a leggyakoribb idegsebészeti, koponyát érintő beavatkozás a krónikus subduralis haematoma eltávolítása lesz. A kórkép gyakran kognitív hanyatlás, járászavar, végtaggyengeség, fejfájás tüneteivel jelentkezik, a diagnózis alapját pedig a koponya-képalkotás képezi. A betegség leggyakoribb kezelési formája a haematoma eltávolítása (evakuációja), amennyiben az tünetet okoz, ugyanakkor a vérzés a sebészileg kezelt betegek 10-20%-ában visszatér.
Anti-GAD cerebellaris ataxia terápiás nehézségei
Bevezetés: A GAD- (glutamát-dekarboxiláz-) ellenes antitestekkel asszociált cerebellaris ataxia ritka, többnyire lassú progressziót mutató kórkép. Jellemző tünetei a törzs- és végtagataxia, a dysarthria és a nystagmus. Normál liquorfehérje-érték és -sejtszám mellett a betegek egy részében oligoclonalis gammopathia mutatható ki. A koponya-MR-en a betegség fennállásának függvényében látható különösen a vermist érintő cerebellaris atrophia. Igen gyakori társulást mutat szisztémás autoimmun betegségekkel. A kimenetel a betegség kialakulásával (szubakut vs. krónikus) és a cerebellaris atrophia fokával mutat korrelációt. Enyhe fokú vagy hiányzó cerebellaris atrophia esetén a betegek várhatóan jobban reagálnak az immunterápiára. Az MR-en látható atrophia fokából valamelyest becsülhető a cerebellaris rezerv. Esetbemutatás: 35 éves férfi betegünk felvételére közel két éve induló, hosszabb tünetmentes periódusokat is mutató egyensúly-bizonytalanság kifejezett, szubakut rosszabbodása miatt került sor. Az immun cerebellaris ataxia diagnózisa a felvételét megelőző napokban igazolódott. Anamnéziséből vitiligo és Hashimoto-thyreoiditis emelhető ki. A korábbi koponya-MR-vizsgálaton kifejezett kisagyi atrophia ábrázolódott. Plazmaferézist és szteroid-lökésterápiát indítottunk érdemi effektus nélkül. A szteroidterápia folytatása mellett iv. immunglobulint alkalmaztunk, a tünetek jelzett javulását észleltük. Azatioprin beállítását kezdtük el, ezt mellékhatások miatt elhagytuk. Tekintettel a betegség kórlefolyásában észlelt időszakos relapszusokra, rituximab alkalmazása mellett döntöttünk, ami tünetstabilizálódást, enyhe állapotjavulást eredményezett. Megbeszélés: Bár a GAD-asszociált cerebellaris ataxia lassú lefolyást mutató, krónikus betegség, a mihamarabbi diagnózis kulcsfontosságú. A gravis cerebellaris atrophia megelőzése, a cerebellaris rezerv lehetőség szerinti megtartása időben elkezdett, adekvát immunterápiával lehetséges. A diagnózist segíti a képalkotó vizsgálaton látott cerebellaris atrophia, illetve a gyakran társuló autoimmun kórképek ismerete. Összefoglalás: Fiatal, autoimmun társbetegségekben is szenvedő, két éve tünetes, anti-GAD cerebellaris ataxia miatt gondozott férfi betegünk státusza plazmaferézis, bolus szteroid, azatioprin, IVIG mellett érdemi javulást nem mutatott. Rituximab hatására állapota stabilizálódott, enyhe javulást sikerült elérnünk. Radiológiai követését a cerebellaris rezerv megítélése céljából MR-spektroszkópiával tervezzük.
Immun-neuropathiák útvesztői a gyakorlatban: a krónikus gyulladásos demyelinisatiós neuropathiától (CIDP) az anti-MAG neuropathiáig
Immunológiai ismereteink bővülésével és az új antitestek felfedezésével a neuroimmunológiai kórképek száma nő. Nem kivétel ez alól a perifériás neuropathiák csoportja sem, diagnosztikai és terápiás kihívás elé állítva a betegcsoporttal foglalkozó kollégákat. Esetbemutatásunk révén, anti-MAG neuropathiás betegünkkel kapcsolatos diagnosztikus és terápiás nehézségeink, valamint a társuló, egyelőre cryptogen strokeesemények okozta kihívások ismertetésén keresztül szeretnénk rávilágítani a perifériás gyulladásos neuropathiás megbetegedések komplexitására. A pár hónapja fennálló, alsó végtagi distalis paraesthesiákkal jelentkező fiatal férfi neurofiziológiai vizsgálata során alsó végtagi szenzomotoros demyelinisatiós neuropathiára utaló képet láttunk. Az ismert antitestek vizsgálata nem hozott pozitív eredményt, a rutin liquorvizsgálat emelkedett összfehérjét mutatott. Az időablak és a progresszív klinikum miatt CIDP-t feltételezve kezdettől intravénás immunglobulin-kezelést alkalmaztunk. Az ezt következő klinikai romlás miatt terápia-eszkalációként szteroidot adjuváltunk. Átmeneti stacioner állapotot követően klinikai és neurofiziológiai romlást észleltük, emiatt másodvonalbeli kezelési lehetőségek irányában immunológiai konzultáció történt. Az előbbi elbíráláshoz szükséges további kivizsgálás új etiológiai aspektusokat nem hozott, a diagnózisrevízió részeként megismételt antitest-meghatározások során azonban anti- MAG-pozitivitást találtunk. A választott rituximabkezelés érdemi eredményt nem hozott. Az ekkor már súlyosan mozgáskorlátozott beteg „salvage” terápiájaként 1 ciklus plazmaferézist alkalmaztunk, sikertelenül. Végül ismételt „expert opinion” konzultációk során biológiaiterápia-váltás helyett a rituximabciklusok folytatása mellett döntöttünk. Ezt követően az összképet komplikálandó, recidív ischaemiás stroke eseményt diagnosztizáltunk betegünknél. Széles körű etiológiai kivizsgálás során az immuneredetű vascularis történéseket is vizsgáltuk, emellett az esetleges nem kívánt terápiás következményeket sem hanyagoltuk el, tumorkutatás is indult, azonban eddig kórokot megállapítani nem tudtunk, így a terápiaválasztás is bizonytalan maradt. Esetünk a holisztikus, rendszerszintű és interdiszciplináris gondolkodás jelentőségét hangsúlyozza. Feltételezzük, hogy a beteg tünetei, melyeket az anti-MAGpozitivitás önmagában nem magyaráz, immunológiai eredetűek. A társuló vascularis események is a kóroki tényezők komplexitására utalnak. Megoldáshoz a neuroimmunológia interdiszciplináris munkamódszerekkel történő fejlesztése vezethet.
RAAS-gátló kezelés – Covid-pandémia
A SARS-CoV-2 okozta különböző méretű és lefolyású akut légzési szindróma ma az egészségügyi rendszerek legnagyobb kihívása világszerte. A Covid-19 klinikai képének kialakulásában döntő szerepe van a renin-angiotenzin-aldoszteron, valamint a kinin-kallikrein rendszernek, illetve ezen rendszereken belül két endopeptidáznak, az ACE és ACE-2 enzimeknek. Az ACE által stimulált Ang II/AT1R tengely káros hatásait (oxidáns, gyulladáskeltő hatás, vasoconstrictio) az ACE-2 által indukált AT2R- és MasR-aktivitás (antioxidáns, gyulladáscsökkentő hatás, vasodilatatio) ellensúlyozza. A SARS-CoV-2 azért okoz ilyen súlyos tüdő- és szisztémás gyulladást, mert az ACE-2-t, mint a tüdő fontos védelmi tényezőjét, károsítja a SARS-CoV-2 fehérjetüskéje az ACE-2-höz kötődéssel, ami az ACE-2-szint csökkenéséhez vezet. Ezzel párhuzamosan fokozott a bradikinintermelődés, amely a BKB1- és BKB2-receptorok révén ugyancsak erősíti a SARS-CoV-2 gerjesztette citokinvihart. Mivel a RAAS-gátló szerek (ACEI, ARB) különböző támadási helyeken és különböző mértékben befolyásolják a két említett szabályozó rendszert és enzimeket, sürgős volt szerepük tisztázása a Covid-fertőzés során, hiszen alkalmazásuk igen kiterjedt és nélkülözhetetlen pillére számos népbetegségnek (hypertonia, cardiorenalis anyagcsere-betegségek). A patofiziológiai és kísérletes adatok alapján jogosan feltételezhető, hogy Covid-fertőzésben a társbetegségekkel járó esetekben – kifejezetten az idős egyéneknél – a csökkent ACE-2-expressziót a RAAS-gátlók helyreállíthatják, és újra érvényesülni tud az elmaradt, vagy csökkent védőhatás. Ez a védőhatás mindkét RAAS-gátlóra érvényes. A klinikai vizsgálatok egyértelműen alátámasztják a különböző nemzetközi társaságok deklarált véleményét, miszerint a RAAS-gátlók alkalmazása nem növeli a Covid-19-előfordulást, illetve a súlyos, kritikus Covid-betegek megjelenésének kockázatát. Ennek értelmében az elindított RAAS-gátló kezelést folytatni lehet és szükséges a Covid-19 betegség kialakulása folyamán.
Paradigmaváltás a krónikus szívelégtelenség gyógyszeres terápiájában
A szívelégtelenség incidenciája, prevalenciája folyamatosan növekszik, a betegség morbiditása és a mortalitása továbbra is nagy, így a kórkép jelentősége óriási, megfelelő kezelése kiemelt jelentőségű. A betegség prognózisát javító érdemi evidenciák továbbra is csak csökkent balkamra-funkcióval járó krónikus szívelégtelenség (HFrEF) kezelése esetén állnak rendelkezésre. Az elmúlt évtizedekben számos „mérföldkővizsgálat” született, melyek eredményei a mai napig alapjaiban határozzák meg a betegség terápiáját. A HFrEF bázisterápiája sokáig három alappillérre épült: angiotenzinkonvertáló-enzim- (ACE-) gátló, β-blokkoló és mineralokortikoidreceptor-antagonista, melyek I/A ajánlási szinttel szerepelnek a különböző szívelégtelenség-ajánlásokban. 2014-ben publikálták az áttörő sikert hozó, nagy jelentőségű PARADIGM-HF (heart failure) vizsgálatot, amelyben egy teljesen új gyógyszercsoportot, az angiotenzinreceptor-blokkoló/ neprilysininhibitor (ARNI-) vegyületek csoportjába tartozó sacubitril/valsartant vizsgálták HFrEF-betegeken. A vizsgálat eredménye szerint a sacubitril/valsartan szignifikáns mértékben, 20%-kal csökkentette a cardiovascularis (CV) halálozás és a szívelégtelenség miatti hospitalizáció primer összetett végpontját, valamint 16%-kal csökkentette az összmortalitást egy aktív komparátorhoz, az HFrEF terápiájában a legnagyobb evidenciákkal rendelkező enalaprilhoz képest. Az Európai Kardiológusok Társasága (European Society of Cardiology, ESC) 2016-os szívelégtelenség-irányelve I/B evidenciaszinttel javasolja a sacubitril/ valsartan alkalmazását ACEI helyett a szívelégtelenség miatti hospitalizáció és halálozás csökkentése céljából olyan ambuláns HFrEF-betegek esetén, akik az optimális ACEI, β-blokkoló (BB) és mineralokortikoidreceptor-antagonista (MRA-) kezelés ellenére is panaszosak maradnak. A későbbiekben sacubitril/valsartannal több kisebb vizsgálatot is publikáltak kissé eltérő indikációkkal és más betegcsoportokon. A PIONEER-HF vizsgálat bizonyította, hogy a sacubitril/valsartan terápia korai, az akut szívelégtelenség stabilizációját követően történő megkezdése biztonságos és hatékony HFrEF-betegek esetén, gyorsabban csökkenti a szívelégtelenség prognózisával korreláló NT-proBNP-szintet, mint az enalapril. A TRANSITION és a TITRATION vizsgálat a sacubitril/valsartan terápia kezdetéről, a dózistitrálás módjáról adott hasznos információkat. A sacubitril/ valsartan megjelenése új korszak kezdetét jelentette néhány évvel ezelőtt a HFrEF terápiájában. Ez a korszak Magyarországon most zajlik. Elképzelhető, hogy az SGLT-2-inhibitoroknak köszönhetően egy újabb korszak kapujában állunk, és erre várhatóan választ ad majd az ESC idén megjelenő új szívelégtelenség-ajánlása.
Koronavírus-betegség reumatológiai betegek körében – a megfertőződés, a súlyos lefolyás és a hatásos vakcináció esélyei
A gyulladásos és reumatológiai betegségekben szenvedők koronavírus-fertőzöttségének gyakorisága nem tér el jelentősen a helyi népesség fertőzöttségi arányaitól. A nagyobb adagú kortikoszteroiddal kezeltek, elsősorban a súlyosabb szisztémás autoimmun betegek megfertőződésének nagyobb a valószínűsége. A hospitalizáció, illetve a mortalitás esélye sem tér el lényegesen a népességi Covid-fertőzöttekétől. E tekintetben is kivételnek számítanak a nagyobb mennyiségű kortikoszteroidokkal és citosztatikumokkal kezeltek. A Covid-prognózist illetően az általában kockázatot jelentő társuló betegségek (a Covid előtti reumatológiai felmérések szerint) ugyanazok a gyulladásos és a nem gyulladásos reumatológiai betegek körében. Ezért nem a reumatológiai betegség miatt súlyos a Covid-kimenetel kockázata, hanem az időskor és az ebben az életkori csoportban egyaránt fellelhető cardiopulmonalis és anyagcsere-betegségek következtében. A gyulladásos reumatológiai/autoimmun betegek kezelésének fegyvertárából hipotetikus alapon a súlyos Covid kezelésére kiválasztott készítmények közül a dexamethason hatásossága bizonyított egyértelműen. Speciális betegcsoportokban kedvező hatása lehet az interleukin-6-antagonistáknak és a JAK-gátlóknak. A reumatológiai és az autoimmun betegségek kezelésére alkalmazott betegségmódosító gyógyszerek, köztük az antimetabolitok, az anticitokin immunológiai készítmények és a JAK-gátlók nem jelentenek Covid-kockázatot, adásukat nem kell megszakítani. Kivétel ez alól a korai B-sejteket közvetlenül elpusztító rituximabkészítmény, amely a súlyos kimenetel esélyét növeli a kezeltekben, feltehetően aktív betegségük és a gátolt humorális immunvédekezés miatt. A Covid-vakcináció szintúgy nem jelent speciális akut kockázatot reumatológiai és autoimmun betegek számára. Hosszabb távon még vizsgálandó, hogy az immunválasz erősségét és tartósságát reumatológiai betegekben a vakcináció speciálisan befolyásolja-e.
A Covid-19 klinikai kimenetelének súlyosságát nemcsak a pszichiátriai kórállapot, hanem a pszichiátriai gyógyszerelés is befolyásolja
SARS-CoV-2-fertőzés esetén a súlyos pszichiátriai betegségben szenvedőknél többnyire rosszabb a klinikai kimenetel leromlott általános állapotuk, kísérőbetegségeik és életmódjuk miatt. A pszichiátriai betegségek közül azonban kiemelten súlyos, elhalálozáshoz vezető kórlefolyással csak szkizofrénia esetében igazolódott szignifikáns összefüggés, amit a többirányú immunzavar is magyarázhat. Amíg a terápiarezisztens szkizofrénia kezelésében használatos antipszichotikum, a clozapin rontani látszik a Covid-19 gyógyulási esélyeit, a depressziós betegek terápiájában alkalmazott antidepresszívumok általában javítják azt, azonban közülük igazán megalapozottan a fluvoxamin esetében igazolható ez a fontos, citokinvihart gátló, a fertőzéses kórállapot súlyosságát mérséklő befolyás.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.