Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 301
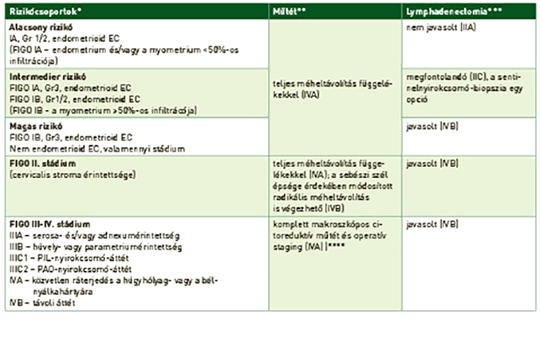
A méh rosszindulatú daganatainak korszerű onkológiai kezelése
Világviszonylatban évente közel 400 000 nőnél igazolódik méhtestrák, amely 2018-ban körülbelül 90 000 nő halálát okozta. Az esetek túlnyomó részét a méhnyálkahártya hormonérzékeny hámjából kiinduló endometriumcarcinomák (EC) alkotják. A sarcomák a méhtestrákok alig 3%-át adják. Az EC-k 80-85%-a jó prognózisú, mivel alacsony gradusú és korai stádiumban kerül felismerésre, amikor a műtét és az esetleges posztoperatív kezelés révén a gyógyulás reális terápiás cél. Az előrehaladott stádiumban diagnosztizált EC és a nem endometrioid altípusok esetén a prognózis lényegesen rosszabb. A magas rizikójú EC optimális adjuváns kezelésére irányuló vizsgálatok egy része még folyamatban van, illetve a bővülő molekuláris ismeretek újabb vizsgálatokat generálnak. A méhtestsarcomák esetében is a sebészi eltávolítás jelenthet kuratív megoldást, az adjuváns kezelésre vonatkozó evidenciák bizonytalanok, egyéni mérlegelést igényelnek. A modern onkoterápia érájában már nemcsak a betegségmentes élet meghosszabbítására, hanem az élet minőségének minél teljesebb megőrzésére is törekszünk. A nőgyógyászati onkológiában ezt jelenti a fertilitás vagy a funkcionáló ováriumok lehetőség szerinti megőrzése; a magas morbiditással járó szisztémás lymphadenectomia indikációs körének szűkítése; a kedvezőbb mellékhatásprofilú brachytherapia alkalmazása a teljes kismedencei besugárzás helyett. A modern onkoterápia az úgynevezett biológiai kezelések által az előrehaladott betegségek ellátásának is a részévé vált: kemoterápia mellett/után progrediáló esetekben a pembrolizumab az EC és a sarcomák esetén is alkalmazható mikroszatellita-instabilitás vagy magas tumormutációs terheltség esetén, míg az NTRK fúziós gén jelenlétében larotrectinib vagy entrectinib mint célzott tirozinkináz-gátlók javasolhatók. Az EC-k 70-80%-át kitevő mikroszatellita-stabil esetekben (nem endometrioid altípusokban is!) a pembrolizumab lenvatinibbel kombinációban adható a kemoterápia után. Az EC területén gyarapodnak továbbá az egyéb célzott terápiás szerekkel szerzett tapasztalatok is (anti-HER2 serosus carcinomában, mTOR-gátló kezelés, endokrin terápia, más immun checkpoint inhibitorok, tirozinkináz-gátlók, PARP-gátlók és kombinációs kezelések). A jelen munka a méhtestrákok onkoterápiájáról kíván rövid összefoglalást nyújtani az aktuális szakmai ajánlások és a folyamatban lévő vizsgálatok bemutatásával.
Agnosztikus terápia onkológiai alkalmazása
A tumoragnosztikus terápia az onkológiai kezelés ígéretes lehetősége, azonban a potenciális célpontok klasszifikálása, validálása, azok egységes módszerek szerinti kimutatása elengedhetetlen. A tumoragnosztikus kezelések engedélyezése új típusú, biomarker-vezérelt klinikai vizsgálatok bevezetését tette szükségessé. Jelenleg három tumoragnosztikus molekuláris célpont ismert: a daganatok magas fokú mikroszatellita-instabilitása (MSI-H), a neurotrop-tirozinkináz-receptor (NTKR) gének fúziója, valamint a daganatok magas tumormutációs terhelése (TMB-H). A pembrolizumab (anti-PD-1 antitest) az első tumoragnosztikus indikációban is törzskönyvezett gyógyszer, amelyet először MSI-H daganatok kezelésére engedélyeztek, majd később a magas TMB is bekerült az indikációk közé. Az NTKR-fúziót hordozó daganatok kezelésére a larotrectinib és az entrectinib került engedélyezésre.
Fókuszban
2020. NOVEMBER 30.
A teriflunomid hatása az agy szürke- és fehérállományára sclerosis multiplexben volumetriás és diffúziós tenzor képalkotás MRI-technikákkal vizsgálva
Egy 12 hónapos, prospektív, obszervációs vizsgálatban a teriflunomiddal kezelt relapszáló típusú sclerosis multiplexes betegek esetében az agyi atrophia mértéke nem mutatott szignifikáns eltérést az egészséges kontrollokétól (sem a teljes agyi, sem a szövetspecifikus [szürke- és fehérállomány], sem regionális [thalamus] szempontból). Ez a jelenség azon alapulhat, hogy a teriflunomid lassítja az agyállomány mikrokárosodásainak akkumulációját.
Az onkológiai gyógyszerész táguló szerepköre
A technológiai haladás felszabadította a gyógyszerészeket, akiknek ma már nem kell a gyógyszerkiadás biztonsági ellenőrzésére fókuszálniuk, és egyre több betegágy melletti feladatot is vállalhatnak, részt vehetnek akár az őssejttranszplantáció kivitelezésében vagy a farmakogenomikai eredmények értelmezésében is.
Zöld utat kapott a magyar Covid-gyógyszer
Széleskörűen hozzáférhetővé válik a magyar betegek számára is a remdesivir nevű hatóanyagot tartalmazó antivirális szer, amely az eddig ismert leghatékonyabb gyógyszer a COVID-fertőzés ellen. A gyártás a Richter Gedeon Nyrt. saját fejlesztése alapján indult. A készítmény klinikai vizsgálata megkapta az engedélyt az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézettől. A szert több magyarországi egészségügyi intézményben, így a Szegedi Tudományegyetemen is alkalmazzák.
Glutamát- és szerotonerg mechanizmus magyarázhatja a rapid antidepresszáns hatást
A Nature kiadójának lapjában (Translational Psychiatry) megjelent vizsgálat megmagyarázza a ketamin paradigmaváltást eredményező hatásának mechanizmusát, és biomarkerrel is szolgál a depresszió kezeléséhez.
A betegbiztonságot erősítik az új hidraulikus, emelt komfortfokozatú betegágyak a Szegedi Tudományegyetemen
Több száz hidraulikus, multifunkciós betegágyat kapott a Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ. A közel kétszáz millió forint értékű eszközfejlesztés jelentős mértékben növeli a betegbiztonságot és az ellátás színvonalát, valamint az egészségügyi dolgozók munkakörülményeit.
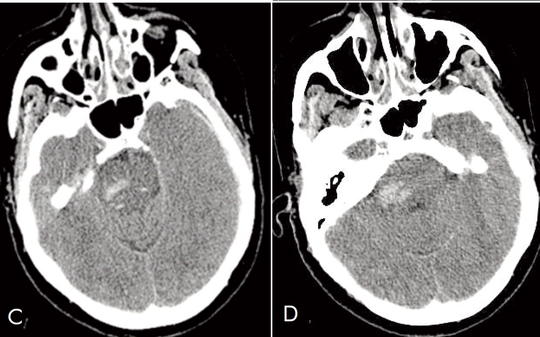
[Subduralis, subarachnoidealis és állományi vérzés egyidejű kialakulása perifériás arteria cerebri media aneurysmaruptura után]
[Az agyi állományvérzés leggyakoribb oka hypertonia, a subarachnoidealis vérzésé érmalformáció megrepedése, a subduralis haematomáé rendszerint koponyatrauma. E háromféle vérzés egy időben, közös okra visszavezethetően ritkán alakul ki. Az intracerebralis aneurysmák gyakorisága a Willis-körtől távolodva csökken, az a. cerebri media distalis szakaszán alig fordul elő, ezek az esetek szinte mindig úgynevezett mycoticus aneurysmák, melyek általában súlyos immundeficiens állapotokban, endocarditisben alakulnak ki. Az 59 éves nőbeteg anamnézisében hypertonia, diétával egyensúlyban tartott diabetes mellitus szerepelt. Trauma nem érte. Felvételére egy napja fennálló, mind kifejezettebb szótalálási nehézség, bal oldali fejtetői fájdalom miatt került sor. Felvételekor enyhe motoros aphasiát észleltünk. Érkezése után néhány perccel comatosussá vált, légzése felületes lett. CT-vizsgálattal bal oldalon, frontoparietalisan subduralis és subarachnoidealis vérzés, mellette állományvérzés ábrázolódott, jobb oldalon a ponsban is állományvérzés látszott. Haemostatisa rendben volt. A subduralis haematoma evacuatióját követően gépi lélegeztetésre volt szükség. Szepszis alakult ki, MRSA igazolódott. Széles spektrumú antibiotikum mellett többször szorult transzfúzióra. Echokardiográfia vegetációt nem igazolt. Neurológiai státusza, vigilitasa fokozatosan javult, per os táplálhatóvá vált. A megkezdett rehabilitációt GM status epilepticus szakította meg. Koponya-CT, CT-angiográfia bal oldalon, az a. cerebri media perifériás szakaszán aneurysmát igazolt. Fizikális státusza alapján két hónappal később vált alkalmassá műtétre, melynek során bal oldali hátsó frontális feltáráson keresztül a corticalis felszínen elhelyezkedő aneurysmát két clippel elláttuk. A műtéti lelet és az érfalból készült szövettani vizsgálat „valódi”, nem mycoticus aneurysmát igazolt. Betegünk kórtörténetének különlegessége az egyidejűleg kialakult érmalformáció okozta subduralis, subarachnoidealis és agytörzsi, infratentorialis vérzés. Az igazolódott aneurysmaesetünk lokalizációjában rendkívül ritka. Még inkább különleges, hogy nem mycoticus aneurysma volt. A beteg maradványtünetekkel, de aktív életet él.]
A késői kezdetű Pompe-kórban szenvedők enzimpótló kezelésének hosszú távú követése
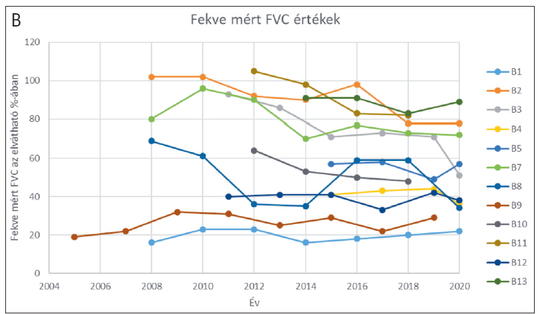
A Pompe-kór (PD) egy ritka lizoszomális tárolási betegség, amit a GAA gén mutációja következtében kialakuló α-glükozidáz (GAA) enzim elégtelen működése okoz. Az enzimdeficientia a glikogén lizoszomális felszaporodásához vezet. A betegségnek két klinikai formája ismert, az újszülöttkori, valamint a késői forma. Jelenleg a betegség hátterében a GAA génnek közel 600 mutációja ismert. A kaukázusi populációban a késői forma hátterében a c.-32-13T>G mutáció a leggyakoribb, az allélfrekvencia közel 70%. A Pompe-kórt enzimpótló terápiával (ERT) tudjuk kezelni, kéthetente Myozyme infúzió adásával. Közleményünkben 13, több mint öt éve kezelt, késői kezdetű formában szenvedő beteg hosszú távú követését mutatjuk be. A leghosszabb követési idő 15 év volt. A kezelés eredményességének megítélésére évente mértük a 6 perces járótávolságot és a légzésfunkciót. Az adatok alapján a 6 perces járótávolság az enzimpótló kezelés indítása után körülbelül 3-4 évig javult, ezt követően az esetek többségében a megtett távolság csökkent. A több mint 10 éves követés után a kezdeti 6 perces járótávolsághoz képest romlást tapasztaltunk az esetek 77%-ában, javulást az esetek 23%-ában. A követés ideje alatt mindössze egyetlen beteg került kerekesszékbe. A légzésfunkció, különösen fekvő helyzetben hasonlóan alakult. A betegek terápiára adott válaszában nagy variabilitást figyeltünk meg, ami csak részben mutatott összefüggést a terápiás fehérje ellen termelődő antitestszinttel. Az ERT eredményessége jelentősen függött a betegséget okozó mutáció típusától, a betegség státuszától a kezelés kezdetekor, a beteg fizikai aktivitásától és táplálkozási szokásaitól. Az innovatív orphan gyógyszerekkel kezelt betegek hosszú távú követése kiemelkedően fontos ahhoz, hogy megismerjük a kezelés valós hasznát és a betegek igényeit.
Gyakorlati tanácsok diabeteses COVID-19-betegek kezeléséhez
A diabetes az egyik legfontosabb társbetegség, amely fokozza mindhárom ismert humán pathogén coronavirus-fertőzés súlyosságát (a COVID-19-betegek 20-50%-a diabeteses). A diabeteses COVID-19-betegek körében nagyobb a hiperglikémia és a súlyos szövődmények kockázata, továbbá a SARS-CoV-2 infekció a hasnyálmirigy károsítása révén az újonnan kialakuló cukorbetegség esélyét is növelheti. A világ 12 országából, 20 vezető szakember által jegyzett Lancet-tanulmány bemutatja a SARS-CoV-2 infekció és a diabetes közötti kapcsolat lehetséges mechanizmusát, és gyakorlati tanácsot ad a diabeteses betegek kezeléséhez.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.