Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Terápiás területek
Immunonkológia
Táplálásterápia szerepe az idős betegek onkológiai kezelésében
A helyes táplálás, táplálkozás megközelítésére két speciális aspektusból kerül sor jelen írásban. Az időskor és a daganatos megbetegedés egyaránt olyan egyedi körülmény, amely a tápanyagszükségletre, annak összetételére, a bevitel módjára hatással van. Áttekintésre kerül a tápláltsági állapot szubjektív és objektív leírása.
Komplex állapotfelmérés idős betegeknél
Magyarországon a lakosság tartós és folyamatos fogyása tapasztalható az 1980-as évek óta, aminek demográfiai jelentőségét a népesség öregedése, a korösszetételének torzulása csak tovább súlyosbít. 1990 óta folyamatosan nő társadalmunkban az időskorúak számaránya, ami 2023-ban 20,54%-ot ért el. Hazánkban a szív- és érrendszeri halálozások mellett továbbra is kiemelt jelentőségű a daganatos betegségekhez társuló halálozás.
Az időskori vérszegénység
Az életkor előrehaladtával a vérszegénység előfordulása egyre gyakoribb. Időskorban nagyon gyakran több krónikus betegség egyidejű jelenlétét tapasztaljuk, amelyek a geriátriai szindrómákkal együtt jelentős mértékben befolyásolják az idős ember önellátó képességét, életkilátásait, életminőségét, valamint a kórházi kezelés szükségességét.
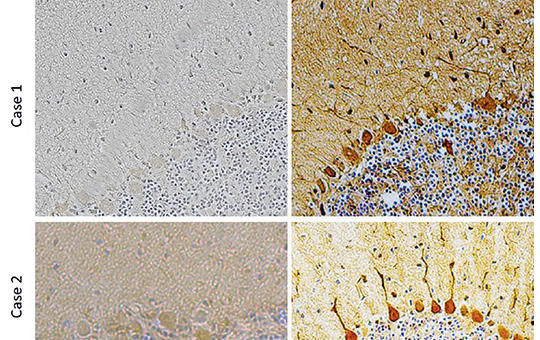
Kisagyi antitestek akut ischaemiás stroke-on átesett betegek szérumában
Bár akut ischaemiás stroke-os (AIS) betegeknél előfordulnak a szérumban antineuronalis antitestek, nem teljesen világos, hogy ezek már a cerebrovascularis esemény előtt jelen vannak, vagy csak később alakulnak ki.
Az onkológiai biológiai kezelések és a magas vérnyomás kapcsolatának elemzése
A biológiai gyógyszerekkel kombinált kemoterápia valódi áttörést jelent a lokálisan előrehaladott és metasztatikus daganatos betegek hatékony kezelésében. Az angiogenezis-gátlás egyik leggyakoribb és klinikailag jelentős mellékhatása a magas vérnyomás kialakulása. Az összefoglaló cikknek az a célja, hogy elemezze a vascularis endothelialis növekedési faktor jelátviteli útvonal gátlói és a magas vérnyomás közötti kapcsolatot. Áttekintjük a VEGF/VEGFR gátlók által kiváltott magas vérnyomás előfordulását, kialakulásának mechanizmusait, a vérnyomásértékek rendszeres ellenőrzésének fontosságát, a lehetséges kezelési stratégiákat és a profilaktikus vérnyomáscsökkentő kezelés hatékonyságát. Összehasonlítjuk a klinikai vizsgálatok eredményeit, hogy tisztázzuk az antiangiogén-kezelés során bekövetkező vérnyomás-emelkedés prognosztikai és prediktív jelentőségét. A biológiai kezelés és a magas vérnyomás közötti kapcsolat további kutatása hatékonyabb, hosszabb túléléssel és jobb életminőséggel járó kezelést eredményezhet az előrehaladott daganatos betegekben.
A vér-agy gát megnyitása fókuszált ultrahang használatával
A neurodegeneratív betegségek, mint például a Parkinson-kór, az Alzheimer-kór, a Huntington-kór és az ALS világszerte jelentős kihívást jelentenek: a betegségek jelenleg gyógyíthatatlanok és olyan beavatkozások sem ismertek, melyekkel progressziójuk megállítható vagy érdemben lelassítható.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.