Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 9
Út a szívhez a vesén át. A residualis cardiovascularis rizikó csökkentésének újabb távlatai – a mesodermalis eredetű szervek kommunikációs útvonalai és mediátorai
A cardiovascularis betegségek továbbra is magas morbiditási adatai a ”maradék” rizikótényezők feltárását indokolják. Az embrionális fejlődés folyamán a cardiovascularis szervek a mesodermából fejlődnek ki, a sejtvonalak között fennmaradó humorális és mechanikus kommunikáció részben magyarázatot ad a maradék cardiovascularis rizikó jelenségére, részben pedig új terápiás célpontok körvonalazódásához vezet.
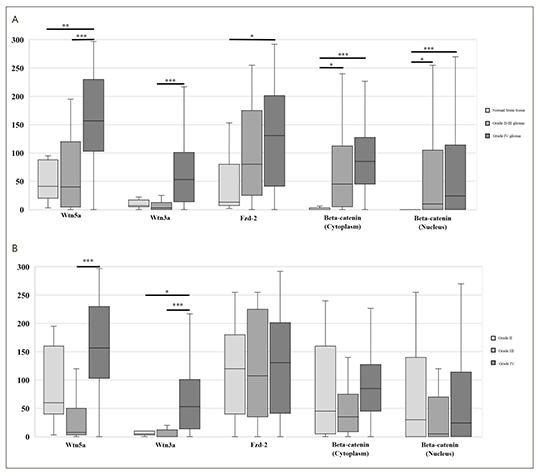
[Wnt-útvonalmarkerek alacsony és magas grádiusú gliomákban]
[A glioma kialakulásában szerepet játszik a Wnt-útvonal aberráns aktiválása az őssejtek differenciálódásának és fenntartásának szabályozása által. Kutatásunk célja volt meghatározni, hogy egyes Wnt-markerek milyen mértékben expresszálódnak a különböző grádiusú, szövettani eredetű és mutációs profilú gliomákban. Kilenc grádius II., 10 grádius III. és 72 grádius IV., műtéti úton eltávolított, formalinfixált paraffinba ágyazott gliomát vizsgáltunk. Az IDH1 132 kodon mutációs állapotát immunhisztokémia és piroszekvenálás módszereivel határoztuk meg minden tumorban. A II. és III. grádiusú astroglialis és oligodendroglialis tumorokat tovább vizsgáltuk p53- és ATRX-expresszióra immunhisztokémiával, és 1p19q kodelécióra fluoreszcens in situ hibridizációval. A nem kanonikus Wnt5a és Fzd2, valamint a kanonikus Wnt3a és β-katenin Wnt-útvonalmarkerek expressziós szintjét immunhisztokémiai úton határoztuk meg, és az expressziós értékeket összehasonlítottuk a tumorok grádiusa, hisztológiai eredete (asztrocitoid vs. oligodendroglioid) és az IDH1 R132H / C mutációk jelenléte vagy hiánya szerinti alcsoportokban. A normál agyi szövet vs. II–IV. grádiusú gliomák összehasonlítása során egy grádius szerinti fokozatos növekedést figyeltünk meg a Wnt5a, Wnt3a, Fzd2 és a β-katenin expressziójában. A II. és III. grádiusú gliomák astroglialis és oligodendroglialis szövettani eredetű összehasonlítása során csak a Wnt5a-expresszió volt szignifikánsan magasabb az asztroglia-alcsoportban. Az IDH1 R132H / C mutáns és vad típusú gliomák összehasonlítása során a Wnt3 emelkedését találtuk a vad típusú grade II–IV. gliomák csoportjában. Ezek az adatok kibővítik a korábbi megfigyelések eredményeit, és összefüggést mutatnak a Wnt-útvonal aktivitása, valamint a gliomagrádius között. A Wnt-markerek expressziós szabályozásának további vizsgálata gliomákban már folyamatban van szövettani eredet vagy IDH-génmutációs státusz szerint, nagy felbontású molekuláris vizsgálatok alkalmazásával.]
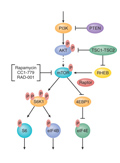
PI3K–AKT–mTOR-jelút gátlása mint terápiás célpont
A PI3K-AKT-mTOR az egyik legforgalmasabb út a sejtjeinkben, jelek fogadásával és továbbadásával, átkapcsolásaival (RAS-út, ligandok), beépített gátlóival (PTEN) a sejtműködés szabályozásának kulcseleme. Ehhez a sejttípusonként eltérő bonyolult rendszerhez megfelelően komplex szabályozás társul. A szabályozásban szereplők hibái (mutáció, amplifikáció, deléció) daganatok kialakulásához vezethetnek, egyben a tumorellenes terápiák fontos célpontjai lehetnek. Engedélyt klinikai alkalmazásra eddig csak négy szer kapott. Ennek a csalódást okozó eredménynek a hátterében számos probléma húzódhat meg. Ilyen a biomarker hiánya, ami a betegek kiválasztását tehetné hatékonyabbá, a grade 3-4 toxicitási mellékhatások magas aránya, a terápiás szer pontatlansága, de az is felvethető, hogy a támadott célpontok nem a daganat meghatározó mozgatói, nem driverhibák. Az a tanulság biztosan levonható, hogy értékelhető klinikai válasz csak kombinált kezeléstől várható.
Prix Galien elismeréssel díjazták a világ első BCL-2 gátló hatásmechanizmusú gyógyszerét, melyet a krónikus limfoid leukémia kezelésére Európában az AbbVie törzskönyvezett elsőként
A gyógyszerkutatás Nobel-díjának tekintett Prix Galien Gálán évről évre felsorakoznak a világ legfontosabb farmakológiai innovációi és a kutatási eredményei. Idén a „Legjobb Gyógyszerészeti Termék” díjat a Venclexta (US)/Venclyxto (EU) (venetoklax) kapta, ami az első törzskönyvezett BCL-2 inhibitor. Az új hatásmechanizmusú gyógyszert elsőként az onko-hematológiai indikációk közül a krónikus limfoid leukémia (CLL) kezelésére fejlesztette ki közösen a Genentech és az Abbvie. A készítményt az Amerikai Egyesült Államokban a két vállalat együttesen, míg az Amerikai Egyesült Államokon kívül az AbbVie forgalmazza.
MEK és ERK - RAS és RAF ellen
A célzott terápia kezdeti klinikai hatása után a legtöbb esetben a tumor rezisztenssé válik a kezeléssel szemben, aminek megfordítása jelenleg az egyik legnagyobb probléma a klinikai onkológiai gyakorlatban. Ennek a szekunder rezisztenciának sok oka lehet, pl. új driver mutáció jelenik meg a kezelt tumorban, az eredeti célponttól eltérő hibát tartalmazó klón lesz a meghatározó, a tumorsejtek funkcióinak, elsősorban proliferációjának szabályozását egy másik jelút veszi át. (Az sem közömbös, hogy a célzott terápiára lokálisan előrehaladt és/vagy metasztatikus tumorok esetében kerül sor.) Ilyen változások igen gyakoriak a RAS-RAF-MEK-ERK jelátviteli úton. A zavarokat főleg mutációk okozzák, és vezetnek a tumorsejtek korlátlan szaporodásához, terjedéséhez. Az egyik kulcsproblémát a RAS mutációi jelentik, amelyek befolyásolása ma még megoldatlan. A leggyakoribb BRAF leggyakoribb mutációját gátlószerekkel sikerült átmeneti klinikai választ elérni, főleg melanomákon. Felmerült, hogy a kóros jelátvitel megakadályozását a jelúton a MEK és/vagy ERK gátlásával lehetne elérni, hiszen ezek aktivitása a fenti hibák miatt fokozottá válik. Ezek a próbálkozások a logikus elgondolás ellenére áttörő sikert még nem értek el. Ez az összefoglaló elsősorban a MEK-kel kapcsolatos eredményeket, a további lehetőségeket tekinti át.
Klinikai Onkológia
2017. MÁJUS 10.
Daganatos őssejtek jelútjai (Notch, Hedgehog, Wnt)
Az embrionális életben, majd később, a szövetek/szervek kialakulásában, differenciálódásukban kulcsszerepet játszanak a fentieket szabályzó, az evolúcióban igen megőrzött jelutak, mint a Notch-, Hedgehog-, Wnt-jelutak. Ezek hibáit sok daganatban kimutatták már, amelyek elősegíti az őssejtszerű geno- és fenotípus (őssejtszerűség, stemness) kialakulását, nemcsak a klasszikus őssejtekben, hanem a progenitor és differenciált sejtekben is (CSC, cancer stem cells). A CSC-k magukban hordozzák az őssejtek olyan tulajdonságait, mint az önfenntartó képesség, a lassú növekedés, a molekuláris hibák hatékony kijavítása, mindezek fontos okozói a rezisztenciának, másrészt adott tumorban a CSC-k a tumor tömegének nagyon kis részét teszik ki, ami rendkívül megnehezíti bennük a megfelelő gyógyszer-kombinációk elérését. Az említett ősi jelutak más jelutakkal is kapcsolatban állnak, jelúthálózatok jönnek létre, ami ugyancsak befolyásolhatja a terápia tervezését. Bár a fentiek arra utalnak, hogy ezek a jelutak elsőrendű terápiás célpontok, az eddigi klinikai eredmények igen szerények, elsősorban az említett problémák miatt. Kevéssé ismert, bár rendkívül fontos az őssejtek mikrokörnyezettel való kapcsolata, ennek sokfélesége, ami akár ellentétes hatásokhoz is vezethet. Az CSC-kkel szembeni hatékony gyógyszerfejlesztés igen nagy kihívást jelent, amit nagyban támogathatnának prediktív biomarkerek, amelyek jelenleg még nem állnak rendelkezésre.
Sejtciklus mint terápiás célpont – CDK4/6-gátlás
A sejt egyik legfontosabb döntése az, hogy életben maradjon-e vagy sem, és ha igen, akkor osztódjon/proliferáljon-e vagy differenciálódjon a neki megfelelő funkció(k) ellátására, esetleg átmenetileg nyugalomba vonuljon-e. Ezek a döntések programok szerint, igen szabályozottan történnek, külső vagy belső molekuláris jelek hatására. A daganatos sejtekben ez a szabályozás romlik el, előtérbe kerül a sejtek szaporodása, amelynek „menetrendje” hasonlít a normális sejtekéhez. Az osztódáshoz vezető eseménysor a sejtciklus, amelynek szabályozásában pozitív és negatív, serkentő és gátló tényezők egyaránt szerepelnek. A sejtciklus egyik, ha nem a legfontosabb ellenőrző pontja, ahol eldől, hogy a sejt folytassa-e a további lépéseket egészen az osztódásig, a leánysejtek keletkezéséig, az a G1/S határ. Ennek a határnak a kulcsszereplője a ciklinD-CDK4/6-RB1 jelút. Jogosan merült fel, hogy ha a daganatsejtekben is hasonló a menetrend, akkor proliferációjukat a CDK4/6 komplex gátlásával meg lehetne akadályozni. Kezdetben olyan szerekkel kísérleteztek, amelyek nem voltak specifikusak, a gátlás az összes komplexre irányult. Ezek a szerek alkalmatlannak bizonyultak, főleg a toxicitásuk miatt. Lényegében ennek tanulságaként jelentek meg a szelektív CDK4/6-gátlók is, biztató klinikai eredményekkel. Jelenleg három olyan szert ismerünk, amelyeket a daganatok kezelésében a klinikai vizsgálatok alapján fel tudunk használni: palbociclib, abemaciclib és ribociclib. A legtöbb adat a palbociclibbel és az emlőrák kezelésével kapcsolatban gyűlt össze, főleg a gátlók és a hormonterápia kombinációjáról. A gátlók hatását sok daganattípusban (pl. liposarcoma, köpenysejtes lymphoma, melanoma, teratomák, veserák, petefészekrák, tüdőrák) vizsgálják. Ugyanez vonatkozik a különböző kombinációkra is. A CDK4/6-gátlók hatása citosztatikus jellegű, a leggyakoribb mellékhatás a neutropenia, mely a tapasztalatok szerint általában jól kezelhető.
A tumornecrosis-faktor-α-gátlók hatása a csontra - A Figyelő 2015;1
Ismert és igazolt tény, hogy szisztémás krónikus gyulladásos betegségekben, elsősorban az ezeket leggyakrabban képviselő rheumatoid arthritisben szenvedőknél fokozott a csontvesztés és nagyobb a törési kockázat. A fokozott csontvesztés és a progresszív osteoporosis kialakulása – in vitro és állatkísérletek alapján – több tényezővel magyarázható...
Új hatásmechanizmusú gyógyszerek az osteoporosis kezelésében
Az osteoporosis jelentős népegészségügyi probléma, terápiás befolyásolása az érdeklődés középpontjában áll. A meglehetősen széles gyógyszeres spektrum ellenére a kezelés nem megoldott. Ezért is áll a kutatások középpontjában az újabb hatásmechanizmusú farmakológiai készítmények fejlesztése.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.