Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Terápiás területek
Onkológia
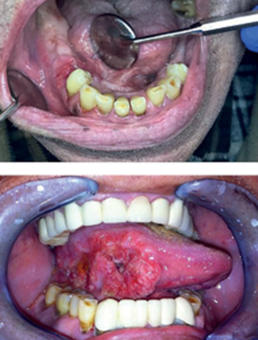
A szájüregi daganatok korszerű kezelése
Magyarországon a szájüregi malignus daganatok száma igen magas. A legfontosabb etiológiai tényezők a dohányzás és alkoholfogyasztás, valamint kisebb mértékben a humán papillomavírusok (HPV) által okozott orális fertőzés. Bár a korai detektálás viszonylag egyszerű, előrehaladott betegség gyakran előfordul. A diagnózishoz és a stádium pontos meghatározásához fizikális, eszközös és képalkotó vizsgálatok szükségesek, amelyek eredménye előrevetíti a túlélést, és meghatározza a további terápiás opciókat. A szájüregi daganatok onkológiai kezelésében az elmúlt 30 évben a diagnosztika és multidiszciplináris terápia túlélésnövekedést, a komplex dentoorális gondozás, valamint a műtéti rekonstrukció fejlődése életminőség-javulást könyvelhet el. A legjobb gyógyeredményeket továbbra is a posztoperatív kemoradioterápiával kiegészített sebészi terápia adja. A táplálkozásban, beszédképzésben és a fej-nyaki régió esztétikájában betöltött fontos szerepe miatt a szájüregi daganatok sebészi kezelése és jó funkcionális eredményekkel történő műtéti rehabilitációja speciális felkészülést igényel. Lokoregionális relapsusok és távoli metasztázisok kezelésében meghatározóvá vált az immunterápia (pembrolizumab, nivolumab) akár monoterápiában, vagy kemo/sugár terápiával kombinálva. A jövőben további biomarkerek, endogén és mikrokörnyezeti faktorok feltérképezése segítheti a hatékony, személyre szabott kezeléseket.
RET-módosult rákok precíziós terápiája RET-gátlókkal
A RET részt vesz egyes szervrendszerek élettani fejlődésében. A RET-módosulások akár génfúziók vagy akár pontmutációk révén történő aktiválása erős onkogén driver a nem kissejtes tüdőrákban, a pajzsmirigyrákban és különböző egyéb rákos megbetegedésekben. RET-módosult daganatokat kezdetben multikináz-inhibitorokkal (MKI) kezelték. Az MKI-k hatékonysága szerény volt, toxicitásuk pedig jelentős az off-target aktivitásuk miatt. A közelmúltban a rendkívül erős és RET-specifikus inhibitorok, a szelpercatinib és a pralszetinib sikeresen átkerültek a klinikai gyakorlatba és az FDA jóváhagyta ezeket a készítményeket. Összefoglaljuk a jelenlegi legmodernebb terápiás módszereket ezen új RET-gátlók preklinikai és klinikai adatainak és a szerzett rezisztenciamechanizmusok, valamint a jövőbeli kilátások áttekintésével.
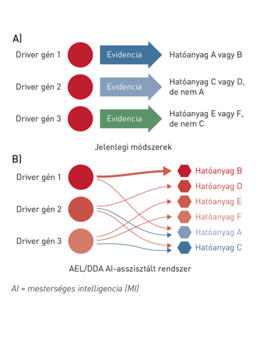
Mesterséges intelligenciával támogatott digitális terápiatervezés a precíziós onkológiában
A precíziós onkológiai megközelítés mára a rutinellátás részévé vált. Egyre több daganatos betegnél készül több száz génes molekuláris diagnosztikai vizsgálat, és több mint 100 célzott vagy immunterápiás gyógyszer van forgalomban. A megnyíló lehetőségek mellett ez kihívást is jelent, hiszen sok esetben több célzott terápiás kezelési lehetőség is rendelkezésre áll ugyanahhoz a biomarkerhez kapcsolódóan, a daganatban párhuzamosan jelen lévő – átlagosan négy-öt – genetikai eltérések módosíthatják a célzott terápiák hatásosságát, sőt egyre több esetben több célozható alteráció is kimutatható egy daganatban. Ilyen esetekben az optimális terápiás terv kialakítása jelenleg a molekuláris tumor boardok (MTB) felelőssége. Azonban több tanulmány kimutatta, hogy komplex molekuláris profilok esetén az MTB-k terápiás javaslata nagyon alacsony konkordanciát mutat. Automatizált döntéshozási módszerekre van szükség, hogy a döntéshozatal hatékonysága mérhetővé váljon, így a metódusok egymással összehasonlíthatók legyenek, és a betegek validált módon a leghatékonyabb döntési módszer alapján juthassanak kezeléshez. A digital drug assignment (DDA) algoritmus lehetőséget nyújt a terápiás döntések standardizálására, ha több célzott vagy immunterápiás kezelési lehetőség áll rendelkezésre, és más iránymutatás nem tesz különbséget a kezelésektől várható klinikai előny tekintetében. A módszer klinikai hasznosságának és biztonságosságának vizsgálata a SHIVA01 klinikai vizsgálat adatain történt.
Hírek a világból
2022. március 11-én az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatósága (FDA) jóváhagyta az olaparib (Lynparza) -kezelést BRCA-mutált, HER-2-negatív, magas kockázatú korai emlőrákos betegek adjuváns kezelésére, akik neoadjuváns vagy adjuváns kemoterápiában részesültek. A betegeket az olaparib FDA által jóváhagyott diagnosztikája alapján kell kiválasztani a terápiára, és március 11-én a Myriad BRACAnalysis CDx tesztjét is jóváhagyták ilyen felhasználásra.
A vékonybél-adenocarcinoma gyógyszeres kezelésének új lehetőségei
A vékonybél-adenocarcinoma (SBA) ritka és rossz prognózisú daganat, az incidencia az utóbbi évtizedekben folyamatosan romló tendenciát mutat. A lokalizált betegség kezelésének alapja a műtét. Az optimális adjuváns és palliatív szisztémás terápiát megalapozó prospektív vizsgálati eredmények híján az SBA gyógyszeres kezelése a colorectalis carcinoma (CRC) kezelési protokollok alkalmazására épült. Azonban a jelenleg folyamatosan bővülő genetikai és molekuláris vizsgálati adatok az egyéb gastrointestinalis daganatoktól eltérő profilra utalnak, és másfajta terápiás megközelítést kívánnak. Jelen közlemény célja áttekintést adni a jelenlegi adjuváns és palliatív kezelési lehetőségekről, a potenciálisan célozható genetikai eltérések, jelátviteli útvonalak legfrissebb kutatási eredményeiről, ezek mentén a legígéretesebb, zajló klinikai vizsgálatokról, amelyek remélhetően alapvetően bővítik az SBA gyógyszeres kezelésének armamentumát.
A célzott kezelések „célzott” mellékhatásai
A célzott gyógyszerek nem elég célzottak, gyakran a normális gének termékeire is hatnak, vagy nem elég szelektívek a mutáns változatokra, így egyáltalán nem elhanyagolható és sajátos mellékhatásaik vannak, aminek patomechanizmusát érdemes ismerni, mert általa a mellékhatások megelőzése vagy „célzott” kezelése lehetséges. Miután a célzott kezelések molekuláris mechanizmusai igen eltérők, ezen mellékhatások spektruma is széles és nagyon eltérő a hagyományos kemoterápiás szerekhez hasonlítva. Az angiogenezisgátlók mellékhatásai a VEGF-mediált folyamatok zavarai (vérzés, sebgyógyulás, vérnyomás-szabályozás), a csontáttét kezelésében használt szerek csontregenerációs zavarokhoz vezetnek az osteoclastfunkció blokkolásával, a HER-2-gátlók szelektív szívizom-károsítók lehetnek, mert ez a receptor kulcsfontosságú az izomregenerációban. Mivel az EGFR a felszíni hám folyamatos megújulásának fő szabályozója, az anti-EGFR-szerek bőrmellékhatásai csaknem természetesek. A multikináz-inhibitorok két fontos célpontja a csontvelő (a KIT kulcsszerepe miatt), illetve a melanocita (hasonló okokból). Az új TRK-inhibitorok esetében idegrendszeri mellékhatások léptek fel, miután az idegsejtek fontos szabályozója az NTRK. A mutáns BRAF-inhibitorok, sajnos, csak szelektívek, és alkalmazásuk során másodlagos, elsősorban RAS-mutáns daganatok keletkezése várható a RAS-RAF-MEK jelpálya sajátos visszacsatolási reakciói eredményeként. A lipidkináz-jelpálya különböző inhibitorai (PI3K, AKT vagy mTOR) megint csak jellegzetes mellékhatásokkal járnak, mint a hyperglykaemia vagy a hyperlipidaemia. Végül az immunellenőrzőpont-gátlók a daganatellenes immunválasz felszabadítása mellett, eddig kontroll alatt levő autoimmun mechanizmusokat is aktiválnak, amelyek adott esetben súlyosak is lehetnek vagy eddig még nem ismert formában manifesztálódnak (hypophysitis).
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.