Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 34
Az immunterápiák pulmonológiai mellékhatásai
Az immuncheckpoint-gátlók megjelenése átírta az onkológiai kezeléseket a szolid tumorok és a hematológiai malignitások esetében is. Ez az áttörés megérkezett a tüdőtumorok kezelésében is.
A vesecarcinoma első vonalas kezelésének lehetőségei, korai tapasztalatok az immun-immun kombinációval
Az előrehaladott és áttétes vesedaganatok kezelése az onkológia dinamikusan változó területe. Az első célzott terápiás készítmény törzskönyvezése óta (2005) szinte évente került sor újabb és újabb készítmények regisztrálására. Az immunellenőrzőpont-gátlók kifejlesztése és az ellátási algoritmusokba való illesztése (2015) tovább bővítette a terápiás palettát. Mindezek ellenére a különböző terápiás vonalakban alkalmazott készítmények kiválasztása sokszor kihívás elé állítja a klinikusokat. A cikkben az első vonalbeli kezelések kerültek összefoglalásra.
Út a szívhez a vesén át. A residualis cardiovascularis rizikó csökkentésének újabb távlatai – a mesodermalis eredetű szervek kommunikációs útvonalai és mediátorai
A cardiovascularis betegségek továbbra is magas morbiditási adatai a ”maradék” rizikótényezők feltárását indokolják. Az embrionális fejlődés folyamán a cardiovascularis szervek a mesodermából fejlődnek ki, a sejtvonalak között fennmaradó humorális és mechanikus kommunikáció részben magyarázatot ad a maradék cardiovascularis rizikó jelenségére, részben pedig új terápiás célpontok körvonalazódásához vezet.
Immunellenőrzőpont-gátló terápiák okozta bőrmellékhatások
Az elmúlt évtizedben az immunellenőrzőpont-gátlók (ICI) megjelenésével az onkológiai betegek ellátása jelentős változáson ment keresztül. Ezen új terápiás szerek megjelenésével új mellékhatásprofilt is meg kellett tanulnunk.
Az autoszomális domináns policisztás vesebetegség és a tolvaptankezelés
Az autoszomális domináns policisztás vesebetegség a leggyakoribb öröklődő vesebetegség, amely a végstádiumú vesebetegségek 5-10%-áért tehető felelőssé. Kialakulását elsősorban a policisztint kódoló gének hibája okozza, amely több jelátviteli úton keresztül fokozott folyadéktranszportot, proliferációt, végső soron a ciszták képződését eredményezi. A diagnózis elsődlegesen az ultrahangos képen és családi anamnézisen alapul. Genetikai meghatározásra csak atípusos formákban van szükség. A klinikumra jellemző a hypertonia, haematuria, proteinuria, a progresszíven csökkenő GFR-szint, illetve az extrarenalis manifesztációk – mint a májciszták, agyi aneurysmák, különböző szívbillentyűhibák jelenléte. Nehézséget a differenciáldiagnosztika során elsősorban a többi cisztás vesebetegségtől való elkülönítése jelent. A terápia megtervezése komplex szemléletmódot igényel, amiben alapvető a progresszió sebességének meghatározása. Ebben segítségünkre lehet a Mayo-klasszifikáció, amely a veseméret alapján prognosztizálja a betegséget, illetve a PROPKD-score, amely a klinikumot és a genetikát is figyelembe veszi. A terápiát eddig elsősorban az életmódváltás, a sószegény diéta, a hypertonia kezelése uralta. 2016 óta rendelkezésünkre áll a vazopresszin-2-receptor-gátló tolvaptan, amely különböző vizsgálatokban (TEMPO 3:3; TEMPO 3:4; REPRISE) a veseméret növekedésének, illetve a GFR-vesztés mértékének lassulását okozta. Összefoglaló közleményünkben a patogenezis és klinikum áttekintése mellett a legújabb terápiás ajánlás legfontosabb pontjait ismertetjük. A kutatási eredmények alapján a jövőben egyéb jelátviteli útvonalak befolyásolásával újabb terápiás lehetőségek állhatnak majd rendelkezésünkre, mint a szomatosztatinanalógok, az EGFR-gátlók és az mTOR-gátlók.
Az artériás életkor meghatározásának klinikai jelentősége
Az artériás öregedés, az emberi szervezet idősödésével együtt járó folyamat, egy adott egyén kronológiai életkorához képest az artériás életkora eltérő lehet. Ennek hátterében genetikai tényezők és számos rizikófaktor hatása áll. Annak ellenére, hogy a kockázatbecslési kalkulátorok nélkülözhetetlenek a prevenciós stratégiák megvalósításában, különbségeket tapasztalhatunk az előre jelzett és a valóban bekövetkező események számában.
A célzott kezelések „célzott” mellékhatásai
A célzott gyógyszerek nem elég célzottak, gyakran a normális gének termékeire is hatnak, vagy nem elég szelektívek a mutáns változatokra, így egyáltalán nem elhanyagolható és sajátos mellékhatásaik vannak, aminek patomechanizmusát érdemes ismerni, mert általa a mellékhatások megelőzése vagy „célzott” kezelése lehetséges. Miután a célzott kezelések molekuláris mechanizmusai igen eltérők, ezen mellékhatások spektruma is széles és nagyon eltérő a hagyományos kemoterápiás szerekhez hasonlítva. Az angiogenezisgátlók mellékhatásai a VEGF-mediált folyamatok zavarai (vérzés, sebgyógyulás, vérnyomás-szabályozás), a csontáttét kezelésében használt szerek csontregenerációs zavarokhoz vezetnek az osteoclastfunkció blokkolásával, a HER-2-gátlók szelektív szívizom-károsítók lehetnek, mert ez a receptor kulcsfontosságú az izomregenerációban. Mivel az EGFR a felszíni hám folyamatos megújulásának fő szabályozója, az anti-EGFR-szerek bőrmellékhatásai csaknem természetesek. A multikináz-inhibitorok két fontos célpontja a csontvelő (a KIT kulcsszerepe miatt), illetve a melanocita (hasonló okokból). Az új TRK-inhibitorok esetében idegrendszeri mellékhatások léptek fel, miután az idegsejtek fontos szabályozója az NTRK. A mutáns BRAF-inhibitorok, sajnos, csak szelektívek, és alkalmazásuk során másodlagos, elsősorban RAS-mutáns daganatok keletkezése várható a RAS-RAF-MEK jelpálya sajátos visszacsatolási reakciói eredményeként. A lipidkináz-jelpálya különböző inhibitorai (PI3K, AKT vagy mTOR) megint csak jellegzetes mellékhatásokkal járnak, mint a hyperglykaemia vagy a hyperlipidaemia. Végül az immunellenőrzőpont-gátlók a daganatellenes immunválasz felszabadítása mellett, eddig kontroll alatt levő autoimmun mechanizmusokat is aktiválnak, amelyek adott esetben súlyosak is lehetnek vagy eddig még nem ismert formában manifesztálódnak (hypophysitis).
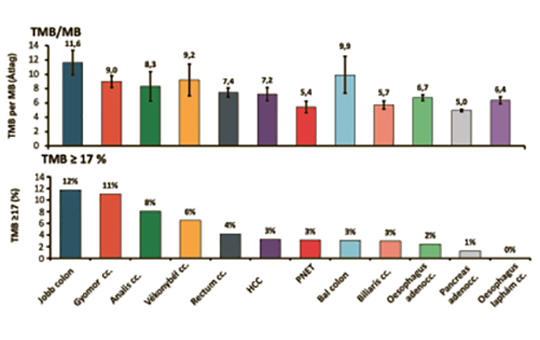
Biomarkerek szerepe a gastrointestinalis daganatok kezelésében
Összefoglaló – A komprehenzív molekuláris profilvizsgálatokon, a bioinformatika fejlődésén alapuló precíziós onkológiai megközelítés, célzott terápia és immunellenőrzőpont-inhibitorok (immune checkpoint inhibitors – ICI) gyökeresen változtatta meg az onkoterápia eredményeit. Az előrehaladott, metasztatikus stádiumú emésztőrendszeri daganatokban szenvedő betegek kedvezőtlen túlélési esélye jelentősen javult az új terápiás lehetőségek alkalmazásától. A sikeres terápia azonban számos molekuláris jellemző ismeretét, meghatározását igényli – PD-L1 expresszió, MSI (mikroszatellita-instabilitás)/dMMR (mismatch repair deficiency), TMB (tumor mutational burden), rezisztenciamutációk, genetikai variánsok jelenléte. Jelen összefoglaló célja áttekintést adni a gastrointestinalis (GI) traktus rosszindulatú daganatainak precíziós onkológiai szemléletű kezelésében alkalmazható prediktív és prognosztikus biomarkerek szerepéről, jelentőségéről.
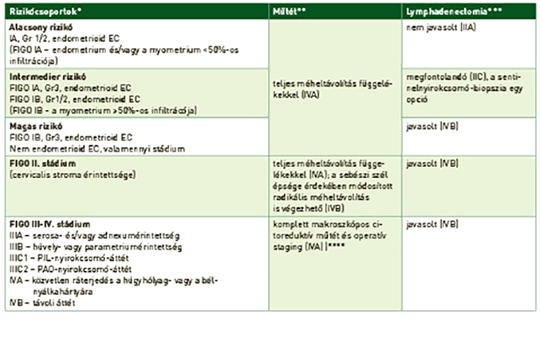
A méh rosszindulatú daganatainak korszerű onkológiai kezelése
Világviszonylatban évente közel 400 000 nőnél igazolódik méhtestrák, amely 2018-ban körülbelül 90 000 nő halálát okozta. Az esetek túlnyomó részét a méhnyálkahártya hormonérzékeny hámjából kiinduló endometriumcarcinomák (EC) alkotják. A sarcomák a méhtestrákok alig 3%-át adják. Az EC-k 80-85%-a jó prognózisú, mivel alacsony gradusú és korai stádiumban kerül felismerésre, amikor a műtét és az esetleges posztoperatív kezelés révén a gyógyulás reális terápiás cél. Az előrehaladott stádiumban diagnosztizált EC és a nem endometrioid altípusok esetén a prognózis lényegesen rosszabb. A magas rizikójú EC optimális adjuváns kezelésére irányuló vizsgálatok egy része még folyamatban van, illetve a bővülő molekuláris ismeretek újabb vizsgálatokat generálnak. A méhtestsarcomák esetében is a sebészi eltávolítás jelenthet kuratív megoldást, az adjuváns kezelésre vonatkozó evidenciák bizonytalanok, egyéni mérlegelést igényelnek. A modern onkoterápia érájában már nemcsak a betegségmentes élet meghosszabbítására, hanem az élet minőségének minél teljesebb megőrzésére is törekszünk. A nőgyógyászati onkológiában ezt jelenti a fertilitás vagy a funkcionáló ováriumok lehetőség szerinti megőrzése; a magas morbiditással járó szisztémás lymphadenectomia indikációs körének szűkítése; a kedvezőbb mellékhatásprofilú brachytherapia alkalmazása a teljes kismedencei besugárzás helyett. A modern onkoterápia az úgynevezett biológiai kezelések által az előrehaladott betegségek ellátásának is a részévé vált: kemoterápia mellett/után progrediáló esetekben a pembrolizumab az EC és a sarcomák esetén is alkalmazható mikroszatellita-instabilitás vagy magas tumormutációs terheltség esetén, míg az NTRK fúziós gén jelenlétében larotrectinib vagy entrectinib mint célzott tirozinkináz-gátlók javasolhatók. Az EC-k 70-80%-át kitevő mikroszatellita-stabil esetekben (nem endometrioid altípusokban is!) a pembrolizumab lenvatinibbel kombinációban adható a kemoterápia után. Az EC területén gyarapodnak továbbá az egyéb célzott terápiás szerekkel szerzett tapasztalatok is (anti-HER2 serosus carcinomában, mTOR-gátló kezelés, endokrin terápia, más immun checkpoint inhibitorok, tirozinkináz-gátlók, PARP-gátlók és kombinációs kezelések). A jelen munka a méhtestrákok onkoterápiájáról kíván rövid összefoglalást nyújtani az aktuális szakmai ajánlások és a folyamatban lévő vizsgálatok bemutatásával.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.