Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 10
Daganattúlélők nőihormon-pótló kezelése – Irodalmi áttekintés
Az onkológia gyors fejlődése az onkológiai betegek mind hosszabb túléléséhez vezet. Közülük egyre többen érik el a természetes menopauzát, vagy onkoterápiájuk mellékhatásaként idő előtt tapasztalják a gonadalis funkciók megszűnését, vazomotoros tünetekkel és hosszú távú negatív cardiovascularis és csontrendszerre gyakorolt hatásokkal. Egyre növekvő számban kérnek ilyen betegek endokrinológiai segítséget hormonpótló terápia (HRT) formájában. A WHI (Women’s Health Initiative) tanulmány eredményeinek téves értelmezése irracionális félelemhez vezetett a nőihormon-pótlás tekintetében mind a betegek, mind az orvosok körében. Számos orvos számára logikus és biztonságos következtetésnek tűnik a HRT elkerülése, feltételezve, hogy ez a hozzáállás biztosan nem okoz kárt, míg az ösztrogén önmagában vagy gesztagénekkel történő alkalmazása onkológiai és thrombemboliás kockázatokat hordoz, szövődmények esetén pedig peres eljárásokhoz is vezethet. Ugyanakkor már a WHI-tanulmány eredményei előtt is ismert volt, hogy a korai menopauza és hypogonadismus a skeletalis és a cardiovascularis hatások révén évekkel csökkenti a nők várható élettartamát, és ez a negatív hatás korrelál a hypoestrogenaemiás időszak hosszával. HRT-ről való döntés esetén ezeket a pró és kontra érveket kell mérlegelni úgy, hogy a HRT onkológiai kockázatát rendkívül nehéz objektíven felbecsülni. Összefoglaló tanulmányunkban áttekintjük a témával kapcsolatos legfrissebb evidenciákat az in vitro kísérletektől a klinikai vizsgálatokig, mind nőgyógyászati, mind nem nőgyógyászati daganatok túlélőinek vonatkozásában. Ez alapján a következő csoportokat határoztuk meg: a „HRT előnyös” (például I-es típusú endometriumcarcinoma, méhnyak-adenocarcinoma, malignus hematológiai betegségek, lokális melanoma malignum, colorectalis carcinoma, hepatocellularis carcinoma); a „HRT neutrális” (például BRCA 1/2 mutációt hordozóknál tumoros megbetegedés nélkül, II-es típusú endometriumcarcinoma, méhcarcinosarcoma és adenosarcoma, egyes ovariumtumorok, méhnyak-, hüvelyi és vulvalaphámrák, prolactinoma, veserák, hasnyálmirigyrák, pajzsmirigyrák); a „HRT relatíve ellenjavallt” különféle okok miatt (például leiomyosarcoma, bizonyos petefészekrákok, agydaganatok, előrehaladott metasztatikus malignus melanoma, tüdőrák, gyomorrák, húgyhólyagrák esetén); a „HRT kedvezőtlen hatású, ezért ellenjavallt” (például emlőrák, endometrium-, stromasarcoma, meningioma, glioma, hormonreceptor-pozitív gyomor- és hólyagrák).
A metasztatikus veserák szekvenciális terápiája
A vesekarcinóma incidenciája a fejlett országokban emelkedő tendenciát mutat, a tumor a 10 leggyakoribb rosszindulatú daganat között van. Az irreszekábilis vesekarcinómás betegek túlélése azonban az elmúlt években jelentősen javult, alapvetően az onkológiai kezelésben elért jelentős előrelépéseknek köszönhetően. A VEGF és az mTOR jelátviteli útvonalra ható szerek használata elterjedt és alapvető klinikai gyakorlattá vált az első és többedvonalas kezelésben. A friss klinikai vizsgálatok számos új támadáspontú (cMET és AXL, FGFR, PD-1/PD-L1, CTLA-4) gyógyszer, illetve ezek kombinációinak a terápiába kerülését biztosították, az új eredmények teljesen átalakították a metasztatikus vesekarcinóma kezelésének lehetőségeit, és jelentősen javítottak a várható klinikai eredményeken is. A közleményben áttekintésre kerülnek a világos sejtes veserák célzott gyógyszeres kezelésének adatai, és jelen tudásunknak megfelelően sor kerül a különféle gyógyszerek és kombinációk terápiás pozíciójának tárgyalására is.
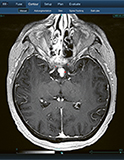
Korai tapasztalataink CyberKnife-kezeléssel suprasellarisan is terjedő hypernephroma-áttét esetén
Intra-, suprasellarisan is terjedő daganatok között ritka az áttét; a leggyakoribb elsődleges daganat a tüdő- és az emlőcarcinoma. Cikkünkben intra- és suprasellarisan elhelyezkedő világossejtes veseáttétes beteg kórtörténetét ismertetjük.
Harmadvonalbeli alkalmazott immmunterápiával elért komplett remisszió vesetumoros nőbetegnél
A nivolumabot, ami egy PD-1 (programozott sejthalál-1) -gátló monoklonális antitest, a sikeres III. fázisú vizsgá-latokat követően először áttétes melanomában, majd nem kissejtes tüdőrákban, később Hodgkin-lymphomában, ezt követően pedig áttétes vesedaganatban regisztrálták. A CheckMate-025 vizsgálatban a nivolumab (kéthetente 3 mg intravénásan) és az everolimus (10 mg/nap) hatásossá-gát hasonlították össze olyan világossejtes vesedaganatos be-tegeknél, akiknek betegsége egy- vagy kéttípusú TKI-kezelés alatt vagy azt követően progrediál. A betegek közel 30%-a harmadvonalban kapta a kezelést.
A világossejtes veserák célzott gyógyszeres kezelése
A veserák a fejlett országokban a tíz leggyakoribb rosszindulatú daganat között van. Incidenciája a közelmúltig folyamatosan emelkedett. Az irreszekábilis veserákos betegek túlélése azonban az elmúlt tíz évben jelentősen javult, a korai diagnózis, illetve a betegség kezelésében történt fejlődésnek köszönhetően. A korábban kemo- és sugárterápia-rezisztensnek tartott betegség biológiai hátterének megértésében nagy előrelépések történtek, melyek a VEGF és mTOR jelátviteli útvonalakra ható szerek bevezetéséhez vezettek, mind az első-, mind a többedvonalas kezelésben. Ezzel egyidejűleg véget ért az elterjedt citokin kezelések korszaka. A friss klinikai vizsgálatok számos újabb hatásmechanizmusú (MET- és AXL-inhibitor, FGFR-inhibitor, PD-1-blokkoló) gyógyszer terápiába kerülését biztosították, ezek az új lehetőségek a vesecarcinoma kezelésének módozatait teljesen átalakították, tovább javítva a betegek progressziómentes és teljes túlélési mutatóit. A közleményben áttekintésre kerülnek a világossejtes veserák célzott gyógyszeres kezelésének adatai, és jelen tudásunknak megfelelően sor kerül a különféle gyógyszerek terápiás pozíciójának tárgyalására is.
Sejtciklus mint terápiás célpont – CDK4/6-gátlás
A sejt egyik legfontosabb döntése az, hogy életben maradjon-e vagy sem, és ha igen, akkor osztódjon/proliferáljon-e vagy differenciálódjon a neki megfelelő funkció(k) ellátására, esetleg átmenetileg nyugalomba vonuljon-e. Ezek a döntések programok szerint, igen szabályozottan történnek, külső vagy belső molekuláris jelek hatására. A daganatos sejtekben ez a szabályozás romlik el, előtérbe kerül a sejtek szaporodása, amelynek „menetrendje” hasonlít a normális sejtekéhez. Az osztódáshoz vezető eseménysor a sejtciklus, amelynek szabályozásában pozitív és negatív, serkentő és gátló tényezők egyaránt szerepelnek. A sejtciklus egyik, ha nem a legfontosabb ellenőrző pontja, ahol eldől, hogy a sejt folytassa-e a további lépéseket egészen az osztódásig, a leánysejtek keletkezéséig, az a G1/S határ. Ennek a határnak a kulcsszereplője a ciklinD-CDK4/6-RB1 jelút. Jogosan merült fel, hogy ha a daganatsejtekben is hasonló a menetrend, akkor proliferációjukat a CDK4/6 komplex gátlásával meg lehetne akadályozni. Kezdetben olyan szerekkel kísérleteztek, amelyek nem voltak specifikusak, a gátlás az összes komplexre irányult. Ezek a szerek alkalmatlannak bizonyultak, főleg a toxicitásuk miatt. Lényegében ennek tanulságaként jelentek meg a szelektív CDK4/6-gátlók is, biztató klinikai eredményekkel. Jelenleg három olyan szert ismerünk, amelyeket a daganatok kezelésében a klinikai vizsgálatok alapján fel tudunk használni: palbociclib, abemaciclib és ribociclib. A legtöbb adat a palbociclibbel és az emlőrák kezelésével kapcsolatban gyűlt össze, főleg a gátlók és a hormonterápia kombinációjáról. A gátlók hatását sok daganattípusban (pl. liposarcoma, köpenysejtes lymphoma, melanoma, teratomák, veserák, petefészekrák, tüdőrák) vizsgálják. Ugyanez vonatkozik a különböző kombinációkra is. A CDK4/6-gátlók hatása citosztatikus jellegű, a leggyakoribb mellékhatás a neutropenia, mely a tapasztalatok szerint általában jól kezelhető.
Orvosokat, betegeket ösztönözné, ha ismernék a gyógyítási eredményeket
Az onkológiák eredményességi mutatóinak közzétételét szorgalmazta a Magyar Klinikai Onkológiai Társaság tiszteletbeli elnöke. Dr. Bodoky György szerint az orvos társaság idei országos kongresszusának ez a legfőbb üzenete valamennyi centrum, illetve a gyógyítók felé: saját példájával várja a csatlakozókat, esetleg döntéshozókat a továbblépéshez.
A veserákok gyógyszeres kezelése
A célzott daganatellenes szerek jelentik az előrehaladott vagy áttétes, világossejtes veserákok standard gyógyszeres kezelését. A gazdagon erezett daganatok progressziójában központi szerepet játszik az érújdonképződés, ennek kulcsmolekulája a vascularis endothel növekedési faktor (VEGF). A törzskönyvezett szerek többsége az angiogenezist gátolja a VEGF jelátvivő út blokkolásával. Az egyik lehetőség a VEGF kötődésének megakadályozása a receptorához (VEGFR) monoklonális antitesttel (pl. bevacizumab), a másik a VEGFR tirozinkináz részének gátlása (pl. sorafenib, sunitinib, pazopanib, axitinib). További lehetőség az mTORC1 gátlása (pl. temsirolimus és everolimus). A nemzetközi ajánlások első vonalban jó és közepes prognózis esetén sunitinib, pazopanib vagy IFNα-bevacizumab adását javasolják. Rossz prognózisú betegeknél ma a temsirolimus a standard. Második vonalban citokin hatástalansága után sorafenib, pazopanib, axitinib alkalmazható. Tirozinkináz-gátlók (TKI) hatástalansága esetén everolimus vagy axitinib adható, újabb ajánlásokban a sorafenib is opció (off label). Harmadik vonalban két TKI után az everolimus rendelkezik regisztrált javallattal. A betegek életkilátásai tovább javulhatnak a célzott készítmények spektrumának bővülésével, egyre hatékonyabb szerek megjelenésével és azok kedvező hatásaival.
Hírvilág
2011. AUGUSZTUS 15.
Nem függ össze a tejfogyasztás és a veserák kockázata
Korábbi kutatásokkal szemben most erősen megkérdőjelezték, hogy a tejivás növelné a veserák kockázatát.
Molekulárisan célzott biológiai terápia a szolid tumorok kezelésében
Közleményünk korábban megjelent első részében összefoglaltuk az emlőrák és a vastag-, illetve végbélrák korszerű, célzott biológiai terápiáját. Ezúttal a gastrointestinalis stromatumor, valamint a hasnyálmirigyrák, a fej-nyak daganatok, a tüdőrák és a veserák molekulárisan célzott biológiai terápiáját ismertetjük, amely vagy monoklonális antitestekkel, vagy orális kinázinhibitorokkal valósítható meg. A specifikusan erre a célra kifejlesztett monoklonális antitestekkel gátolhatjuk a sejtek felszínén elhelyezkedő receptorokat (például fej-nyak laphámráksejteken az epidermalis növekedési faktor receptorait) vagy az áttétek növekedéséhez szükséges ligandot (például a vascularis endothelialis növekedési faktort veserákban). A kis molekulatömegű, orális kinázinhibitorok a sejten belüli jelátviteli utakat blokkolják, például az imatinib és a sunitinib gastrointestinalis stromatumorban, az erlotinib hasnyálmirigyrákban, az erlotinib és a gefitinib tüdőrákban, a sunitinib és a sorafenib veserákban, valamint a sorafenib májrákban. Az mTORgátló temsirolimust veserákban alkalmazhatjuk.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.