Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 11
RET-módosult rákok precíziós terápiája RET-gátlókkal
A RET részt vesz egyes szervrendszerek élettani fejlődésében. A RET-módosulások akár génfúziók vagy akár pontmutációk révén történő aktiválása erős onkogén driver a nem kissejtes tüdőrákban, a pajzsmirigyrákban és különböző egyéb rákos megbetegedésekben. RET-módosult daganatokat kezdetben multikináz-inhibitorokkal (MKI) kezelték. Az MKI-k hatékonysága szerény volt, toxicitásuk pedig jelentős az off-target aktivitásuk miatt. A közelmúltban a rendkívül erős és RET-specifikus inhibitorok, a szelpercatinib és a pralszetinib sikeresen átkerültek a klinikai gyakorlatba és az FDA jóváhagyta ezeket a készítményeket. Összefoglaljuk a jelenlegi legmodernebb terápiás módszereket ezen új RET-gátlók preklinikai és klinikai adatainak és a szerzett rezisztenciamechanizmusok, valamint a jövőbeli kilátások áttekintésével.
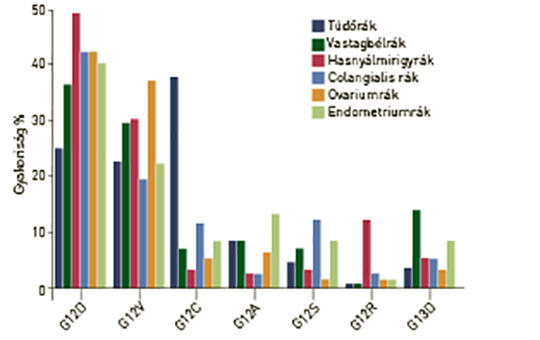
A (K)RAS-mutáció molekuláris epidemiológiája emberi daganatokban
A RAS onkogén mutációja a leggyakoribb génhiba emberi daganatokban, és a három családtag közül a K-RAS-é a leggyakoribb, amit az N-RAS követ. A tipikus K-RAS-mutáns daganatok a hasnyálmirigyrák, vastagbélrák és tüdő-adenocarcinoma, amelyekben a mutáns variáns allélok gyakorisága igen heterogén, aminek hátterében eltérő karcinogenezis áll. A RAS-mutáns daganatok genetikai sokszínűségét tovább fokozza, hogy a mutáns allél homo- vagy heterozigóta formában van-e jelen. A sokszínűség egy másik forrása az, hogy a különféle daganatokban a K-RAS-mutánsok esetében sajátos kísérő mutációs mintázatú altípusok lehetnek. Mindezeknek az a következménye, hogy a K-RAS-mutáns daganatok biológiai viselkedése és nagy valószínűséggel terápiás érzékenysége is nagyon heterogén lehet. A K-RAS-inhibitorok klinikai debütálásával ezeknek a kérdéseknek egyre nagyobb jelentősége lesz.
A hypoxia jelentősége a rosszindulatú daganatok progressziójában: terápiás lehetőségek, út a Nobel-díjhoz
Az elmúlt évtizedek kutatásai világossá tették, hogy a malignus daganatok egyik meghatározó jellemzője hypoxiás állapotuk és az ennek következtében aktiválódó genetikai, biokémiai és biológiai programok. A felismerés jelentőségét mi sem bizonyítja jobban, mint hogy 2019-ben az orvosi Nobel- díjat ezért ítélték oda a terület meghatározó tudósainak. A daganatszövetben keletkező hypoxia fő oka a proliferációval lépést nem tartó ereződés, de másik fontos oka a daganatos beteg szisztémás hypoxiája is. A hypoxiára adandó sejtes válaszok alapja a hypoxia indukálta (transzkripciós) faktorok stabilizálódása és aktivizálódása, ami azonban daganatokban az onkogén jelpályák konstitutív aktivitása miatt is bekövetkezhet hypoxia nélkül is. A daganatos hypoxia következménye az angiogén fenotípus, a sejtmetabolizmus átprogramozódása és a daganatellenes immunológiai válaszreakciók kedvezőtlen modulációja. A daganatszövet hypoxiája azonban negatívan befolyásolja a kemo-, sugár- és immunterápia hatékonyságát is. Mindezek miatt nagy szükség lenne a daganatos hypoxia célzott terápiájára, aminek első eszközei még csak most lépnek be a klinikai gyakorlatba. Fontos megjegyezni, hogy hazai kutatócsoportok nemzetközileg is elismert eredményekkel járultak hozzá ismereteink bővüléséhez ezen a területen.
Tumormetabolizmus
Napjaink egyik fontos kérdése, hogy a daganatsejtekben eddig megfigyelt és mára egyre jobban jellemzett onkogén hatások (genetikai és epigenetikai) eredményeként bekövetkező anyagcsere- változások és a primeren jelentkező és ezen keresztül létrejövő metabolikus át- vagy újraprogramozás (metabolic reprogramming) hogyan befolyásolja a tumorok kialakulását, progresszióját és terápiás válaszkészségét. A különböző tumorsejtek metabolikus változásai egyedi variációkat jelentenek, és ezek alapján adott daganatok (akár szövettani típustól független) eltérő metabolikus profillal rendelkezhetnek, típusonként eltérő tápanyagigénnyel és tápanyag-hasznosítási útvonallal (glikolízis, glutaminolízis, zsírsav-oxidáció, autofágia stb.) jellemezhetőek. Előbbi változások biológiai következményei számos ponton befolyásolják a daganatsejtek túlélési, proliferációs, metasztatikus viselkedését és mikrokörnyezeti változásait. Abban az esetben, ha adott metabolikus fenotípusok megjelennek, vagy irreverzibilis változásokat eredményeznek az adott tumorsejtekben, akkor olyan kezelések, amelyek ezeket a folyamatokat érintik, várható terápiás sikereket eredményezhetnek.
Onkogénekre irányuló kezelések nem kissejtes tüdőrákban
A tüdőrák a tumoros eredetű halálozás vezető oka, globálisan az egyik fő népegészségügyi probléma. A nem kissejtes tüdőrák (NSCLC) adja az összes tüdőrákos eset kb. 85%-át. Történelmileg a platinaalapú kemoterápia volt az NSCLC szisztémás kezelésének fő pillére, ami kb. csak 8-10 hónapos medián túlélést eredményezett. Az NSCLC kezelésében bekövetkezett jelentős javulást azoknak a legfontosabb genetikai hibáknak (onkogén driverek) az azonosítása idézte elő, amelyek beindítják a tumor kialakulását, fennmaradását és progresszióját, és elősegítik a hatékonyabb daganatellenes kezelések kifejlesztését. Az epidermalis növekedési faktor-receptor (EGFR) és az anaplasticus lymphomakináz (ALK) elleni kezelések, együtt a célpontok kimutatására irányuló módszerekkel, a már előrehaladott NSCLC-ben szenvedő betegek standard kezelését jelentik. További ösztönzőként az utóbbi években számos újabb genetikai hibát azonosítottak új molekuláris célpontként, a tüdőrák esetleges terápiás lehetőségeként. Ebben a cikkben az előrehaladott NSCLC onkogénekre irányuló kezeléseit foglaljuk össze, az ezeket gátló rezisztenciával, valamint röviden bemutatásra kerülnek a fejlesztés alatt álló új, onkogéneket célzó kezelések.
A hepatitis C-vírus szerepe a non-Hodgkin lymphomák kialakulásában
A krónikus hepatitis C-vírus-fertőzés és egyes B-sejtes non-Hodgkin lymphomák közötti kapcsolatot egyre több bizonyíték támasztja alá. Az asszociált lymphomák gyakran kevert, 2-es típusú cryoglobulinaemia talaján alakulnak ki.
Szomatikus onkogén mutációk a pajzsmirigy daganataiban
Írásunkban „távoli” területre kalauzoljuk olvasóinkat, az elmúlt 25 évben egyre növekvő incidenciájú pajzsmirigydaganatok kialakulásának genetikai hátterét szeretnénk egy kicsit körüljárni.
Hírvilág
2013. JANUÁR 21.
A sejtburjánzás szelektív blokkolása
A négyes DNS-spirál felfedezése áttörést jelenthet a rákgyógyászatban
FÓKUSZBAN AZ ONKOLÓGIAI BETEGSÉGEK Az olvasók kérdéseire szakértõ válaszol
- Régen onkogén forrásként tartották számon az úgynevezett mateabusust, a bagórágást, illetve az extrém magas hőmérsékletű ételek fogyasztását, amelyek esetén gyakrabban alakultak ki szájüregi, gége- és garatdaganatok. Napjainkban milyen károsító tényezőkről bizonyították be, hogy hozzájárulhatnak az egyre gyakoribb szájüregi daganatok kifejlődéséhez?
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
Hasnyálmirigyrák: az ESMO klinikai gyakorlati irányelve a diagnózishoz, kezeléshez, követéshez*3.
Klinikai Onkológia
Gyógyszerbiztonsági szemelvények – a múlt tanulságai és a jövő lehetőségei4.
5.