Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 12
Epehólyag- és epeúti daganatok kezelése
Az epeeredetű daganatok (BTC-k: epehólyagrák, intrahepaticus és extrahepaticus epeúti daganat) olyan heterogén rosszindulatú daganatok, amelyek jelentősen eltérő epidemiológiai, klinikai és molekuláris jellemzőkkel rendelkeznek.
A kis dózisú komputertomográfiával történő tüdőrákszűrés hazai bevezetésének kérdései
A tüdőrák hazai előfordulása viszonylag jelentős, hasonlít más közép-európai országok átlagához. Ahhoz, hogy a betegek életkilátásai jelentősen javuljanak, a legjobb megoldás a korai diagnosztika, amelynek klinikai szempontból eredményes módszere a kis dózisú komputertomográfia. A nemzetközi és hazai szakmai ajánlások ellenére szervezett, országos szintű tüdőrákszűrés egyelőre kevés helyen történik a világon.
Felix D’Mello környezettoxikológiai kézikönyve I.
Felix J. P. D’Mello 1968-ban helyezkedett el az Edinburgh School of Agriculture intézetében és kezdte meg ott kutatásait. Nyugdíjba vonulása óta is több kitűnő könyvet szerkesztett a CABI Publishing számára, köztük A Handbook of Environmental Toxicology: Human Disorders and Ecotoxicology című kiadványt is. A szóban forgó kötet 40 fejezetből áll, amit a bolygó különböző pontjain élő szakspecialisták írtak.
Sugárterápia indukálta másodlagos daganatok
Az onkológiai kezelések szerves részét képezi a sugárterápia, amiben a betegek közel fele részesül. A modern onkológiai kezeléseknek köszönhetően a túlélés egyre hosszabb, így a betegek körülbelül egyötöde megéli azt is, hogy egy második tumor kialakuljon. Több tanulmány szerint maga az onkológiai kezelés is összefüggésbe hozható a másodlagos primer tumor kialakulásával, ami egyes becslések szerint az esetek 5-8%-ában lehet a sugárterápia következménye. Nagy kihívást jelent, hogy megértsük a sugárterápia okozta hatásokat az esetlegesen túlélő daganatsejtekben, a daganatot körülölelő egészséges szövetekben, az alacsony dózisban részesült területekben, illetve az egyáltalán nem irradiált szövetekben, ahol abszkopális hatások érvényesülhetnek. Ezek együttes hatása tehető felelőssé az úgynevezett radiokarcinogenezis kialakulásáért. Manapság számos tanulmány foglalkozik a sugárterápia daganatindukáló hatásaival. Ez az összefoglaló arra hivatott, hogy áttekintse a témával kapcsolatos ismereteinket a patogenezis, radiogenomikai, sugárfizikai és sugárbiológiai szempontok alapján, továbbá tárgyalja a megelőzés és a szűrés lehetőségeit. A sugárterápia kétélű fegyver, amely egyrészt nagyon jól alkalmazható a daganatos betegségek kuratív kezelésében, másrészt azonban potencionálisan másodlagos daganatot indukálhat, amely évekkel később jelentkezik. Emiatt a jövőben a maximálisan optimalizált, személyre szabott sugárterápiának lehet csak létjogosultsága.
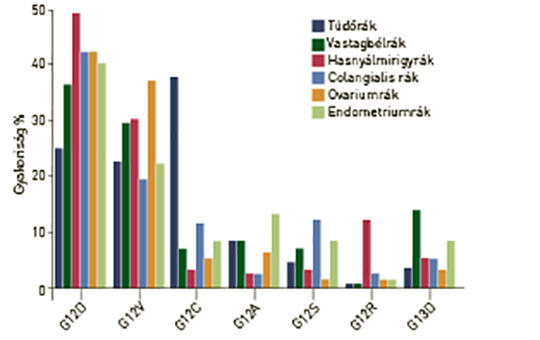
A (K)RAS-mutáció molekuláris epidemiológiája emberi daganatokban
A RAS onkogén mutációja a leggyakoribb génhiba emberi daganatokban, és a három családtag közül a K-RAS-é a leggyakoribb, amit az N-RAS követ. A tipikus K-RAS-mutáns daganatok a hasnyálmirigyrák, vastagbélrák és tüdő-adenocarcinoma, amelyekben a mutáns variáns allélok gyakorisága igen heterogén, aminek hátterében eltérő karcinogenezis áll. A RAS-mutáns daganatok genetikai sokszínűségét tovább fokozza, hogy a mutáns allél homo- vagy heterozigóta formában van-e jelen. A sokszínűség egy másik forrása az, hogy a különféle daganatokban a K-RAS-mutánsok esetében sajátos kísérő mutációs mintázatú altípusok lehetnek. Mindezeknek az a következménye, hogy a K-RAS-mutáns daganatok biológiai viselkedése és nagy valószínűséggel terápiás érzékenysége is nagyon heterogén lehet. A K-RAS-inhibitorok klinikai debütálásával ezeknek a kérdéseknek egyre nagyobb jelentősége lesz.
A biológiai óra és a daganatok
Jelen összefoglalásban képet adunk a biológiai ritmusok közül a cirkadián ritmusról, annak szabályozásáról és a tumorgenezissel való kapcsolatáról. Cirkadián ritmusnak nevezzük azt a biokémiai, fiziológiai folyamatokban fellépő nagyjából 24 órás ciklust, amely az egysejtűektől a gerincesekig megtalálható. Ez a biológiai ritmus az endogén belső óráink és a fény mint fő „Zeitgeber” szinkronizációjának eredménye. Az emlősökben a hypothalamus területén elhelyezkedő nucleus suprachiasmaticus (SCN) tekinthető a szervezet „főórájának”, ami felelős a különböző szervrendszerekben található perifériás órák összehangolásáért. A cirkadián ritmus szabályozása az úgynevezett „circadian locomotor output cycles kaput”, a CLOCK géneknek a feladata. A CLOCK gének más effektor génekre hatva, a fehérjeszintézis diurnalis ritmusát szabályozzák. A cirkadián ritmus celluláris mechanizmusainak feltárását 2017-ben Nobel-díjjal jutalmazták. Egyre több adat bizonyítja a CLOCK gének és a daganatok kialakulása közötti összefüggést. Több tanulmány kapcsolatot mutat a váltott műszakban történő munkavégzés és az emlő-, valamint prosztatarák kialakulása között, valamint egyes cirkadián ritmust szabályozó gének mutációja és a tumoros elváltozás kifejlődése között. Egyre több adat utal a tumormetabolizmus és a CLOCK gének, azok szabályozása közötti kapcsolatra is. Mindezen adatok alapján a cirkadián ritmus, így a napszakok figyelembevétele a daganatterápiás kezelés során indokolttá válhat.
A gyulladás szerepe a daganatok kialakulásában
A krónikus gyulladás (például pancreatitis, colitis, bronchitis) számos daganatféleség esetében a karcinogenezis fontos előmozdítója és a keletkező genetikai hibák egyik okozója is, az ismert karcinogének mellett. Az érintett szövetek hámjának folyamatos regenerációja mellett a krónikus gyulladás olyan intra- és extracelluláris környezetet teremt, amely kedvez a malignus transzformációnak és blokkolja az esetleges immunválasz kialakulását is. Legújabb ismereteink szerint a szolid daganatok maguk is intenzív krónikus gyulladást generálnak teljesen függetlenül attól, hogy magának a daganatnak a kialakulásában ez a folyamat szerepet játszott-e. Ennek kiváltó okai a daganatos necrosis és a daganatszövet által termelt gyulladásos citokinek. A daganatindukált gyulladásos reakció blokkolja a daganat elleni hatékony immunválaszt, és egyes elemeinek monitorozása a daganatos progresszió klinikai markere lehet.
Vegyi anyagok és daganatok
A daganatképződés hátterében nem letalis genetikai hibák állnak, elsősorban meghibásodott szabályozórendszerek, mint a szuppresszor gének inaktivációja, sérülése, elvesztése, a protoonkogének aktivációja, amplifi kációja, az apoptózisgének sérülése vagy a DNS-repair gének funkciócsökkenése. Számos vegyi anyag a sejtben DNS-mutációt hoz létre a fenti szabályozó génekben, ezzel iniciálja a sejtet a folyamatos proliferációra, teret adva további mutációk felszaporodásának. A mutációt okozó (genotoxikus) vegyi anyagok általában megnövelik a daganat-előfordulási rátát, karcinogének.
Az amerikai klinikai onkológiai társaság 2019. Évi Kongresszusának legfontosabb újdonságai
Az „Education Section” egyik nagy érdeklődésre számot tartó szekciója a DDR: the DNA response revolution volt (1). A korszerű új generációs teljesgenom-szekvenálások révén nemcsak a daganatok „driver” génjeiről kapunk információt, hanem lehetőséget adnak arra is, hogy a karcinogenezis szempontjából alapvető etiológiai faktorokat is azonosítsuk, mivel ezek ott hagyják újlenyomataikat az emberi genomban (lásd például az UV- vagy a dohányzásindukált báziscseréket). Ebből a szempontból fontos megfi gyelés az, hogy a tüdőrákokban egyértelműen azonosítható az arzén okozta génhibatípus elsősorban a nemdohányzókban.
Az áttétes colorectalis rák molekuláris altípusai és a terápiás döntések fejlődése
A colorectalis ráknak (CRC) klinikailag igen jelentős molekuláris heterogenitása van, amely különböző szinteken jelentkezik: a genomikában, az epigenomikában, a transzkripcióban és a mikrokörnyezetben. A karcinogenezis során szerzett genomikus történések hajtják („drive”) áttétes helyzetben a rák progresszióját. Például a KRAS- és az NRAS-mutációk jelzik azokat a daganatsejt-populációkat, amelyek refrakterek az EGFR monoklonális antitestekre, a BRAFV600E-mutációt hordozók viszont rosszabb kimenetelre számíthatnak a standard kezelések és a kombinált célzott kezelések mellett, míg a HER2-amplifi káció arra utal, hogy a daganat különlegesen érzékeny egy kettős HER2-blokáddal szemben. A többszörös, ritka géneltérések által hajtott EGFR monoklonális antitestek elleni rezisztencia jelentős átfedésben van a primer, valamint a szerzett rezisztencia mechanizmusában a klónszelekciós folyamat során. Ebben a tekintetben refrakter esetekben a keringő tumor-DNS szekvenciális vizsgálata vezethet gyógyszerek kifejlesztéséhez. A ritka kinázfúziós események és a DNS-károsodás utáni repair-ben részt vevő gének komplex eltéréseit is leírták, amelyek a célzott kezelések targetjei lehetnek. Másrészt a transzkripció szubtípusai és a jelátviteli utak aktivációs jelei szintén prognosztikai és potenciálisan prediktív értékkel bírnak áttétes colorectalis rákban. Ezek a jelek a stromalis sejtek és az immunkörnyezeti sejtek, valamint a daganatsejtek közötti interakciókat jelzik. Például a mikroszatellita-instabilitást mutató (MSI) vagy a POLE ultramutáns CRC-daganatsejtek különlegesen érzékenyek az immunellenőrzőpont-gátlókra, míg az olyan mesenchymalis fenotípusú daganatok, amelyeket az immunszuppresszív molekulák aktivációja jellemez, jó tárgyai lehetnek egy új immunterápiás kombináció kialakítására. Ebben a cikkben átnézzük az áttétes CRC-ben kimutatott, célzott terápiára alkalmas onkogéneltéréseket és -szignatúrákat, valamint tárgyaljuk az új molekuláris diagnosztikus próbák klinikai alkalmazásának lehetőségeit.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.