Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 362
Folyamatos EEG-monitorozás neurológiai szubintenzív osztályon
Kritikus állapotú betegnél az agyi funkciók károsodása akár órákkal is megelőzheti a neurológiai fizikális vizsgálattal észlelhető állapotromlást. A corticalis funkciók folyamatos tér- és időbeli követésére a tartós EEG- (continuous EEG, cEEG) monitorozás érzékeny vizsgálómódszer. Vizsgálatunk célja az OMIII Szubintenzív osztályán a cEEG-monitorozás klinikai alkalmazhatóságának vizsgálata súlyos idegrendszeri kórképekben.
Intracranialis meningeomák gamma-sugársebészeti kezelésének lehetőségei. Szakmai irányelvek, tapasztalatok
A meningeomák az egyik leggyakrabban előforduló, többnyire jóindulatú intracranialis daganatok, melyek az arachnoidea meningothelialis sejtjeiből származnak. Lokalizációjukat tekintve változatosak, a központi idegrendszer bármely területén elhelyezkedhetnek, ahol agyburkok is megtalálhatók. Tüneteket azáltal okoznak, hogy a környező ép agyállományra vagy képletekre direkt nyomást gyakorolnak, azok normális működését akadályozzák. Tüneteket ennek ellenére sokszor csak későn okoznak, mivel egy ideig az agy jól kompenzálja a daganat által okozott változásokat. Ebben a stádiumban elfogadott a követés, a konzervatív hozzáállás. A műtéti indikációt bizonyított növekedés, térfoglalás, oedema megjelenése, kieséses tünet vagy epilepszia megjelenése esetén állítunk fel. A daganat progressziója esetén elsősorban nyílt műtét lehetősége merül fel. A reziduális tumorszövet kontrollálására magas kockázatú műtétek eseteiben, amennyiben a lehetőségek azt megengedik, sugársebészeti, sugárterápiás beavatkozások lehetnek szükségesek, akár a hagyományos műtétek kiegészítéseként.
EEG-alapú agyi funkcionális konnektivitásvizsgálat epilepsziákban
A krónikus fájdalomszindrómák több mint 80 millió embert érintenek Európában. A gyógyszeres kezelésre nem reagáló deafferentációs fájdalmak csökkentésére már 1954-ben publikálta Heath a mély agyi stimulációs módszert.
Nézetváltozások az epilepszia keletkezéséről és mechanizmusáról. Rendszeralapú megközelítés
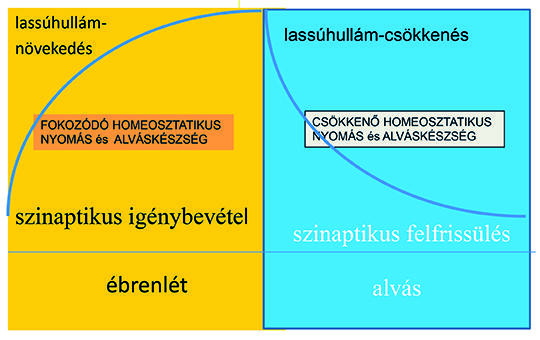
Az epileptogenesis útjainak vizsgálata a rendszerepilepszia-koncepció mentén. Irodalmi áttekintés és saját tapasztalatok alapján ismertetjük a deklaratív memóriarendszer, az alvás/ébredés és a perisylvian kommunikációs rendszer epilepsziás átalakulását, majd az epileptogenesis folyamatát bemutatjuk az agyi sérülések és a poszttraumás epilepszia modelljén is. Az ismertetett rendszer-epilepsziák kialakulásában közös lépések ismerhetők fel a plaszticitás és a NREM-alvás alatti szinaptikus homeosztázis felfokozódásában, ami egyben rávilágít az alvás döntő szerepére epilepsziában. Megkíséreljük körvonalazni a rendszerepilepszia-koncepciót, és az egymással összefüggő plaszticitás – alvási szinaptikus homeosztázis „kisiklása” formájában rámutatunk az epileptogenesis lehetséges közös patomechanizmusára.
[Relapszáló-remittáló betegségnek tarthatjuk-e a Parry–Romberg-szindrómát?]
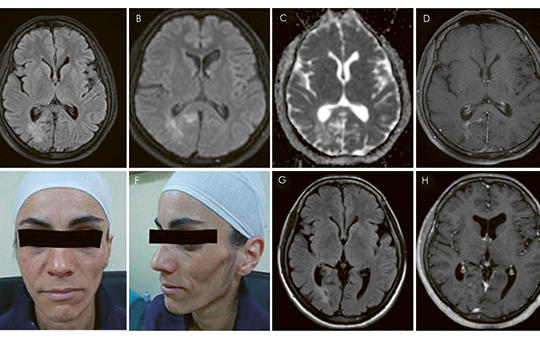
[A progresszív hemifacialis atrophia néven is ismert Parry– Romberg-szindróma ritka, lassan progrediáló betegség, amit az arcbőr és az arc bőr alatti kötőszöveteinek egyoldali, fájdalmatlan atrophiája jellemez. A kórkép viszonylag gyakran (az esetek 15–20%-ában) jár együtt neurológiai manifesztációkkal (epilepszia, migrén, trigeminusneuralgia). A lehetséges okok között a következő etiológiai tényezőket tartják számon: fertőzés, az embrionális fejlődés zavara, szimpatikus diszfunkció, autoimmun betegség. Esetismertetésünkben bemutatjuk egy 37 éves nő kórtörténetét, akinek betegsége kétéves periódusban relapszáló-remittáló betegséglefolyásra emlékeztető, dinamikus kontrasztfokozott fehérállomány-elváltozásokkal jelentkezett. Szisztémás gyulladásos aktivitást, gyulladásos jeleket a cerebrospinalis folyadékban, pozitív szérum-autoantitesteket mutattunk ki, ami a beteg korábban felfedezett autoimmun betegségével együtt az autoimmun-gyulladásos kóreredet hipotézisét támogatja.]
Idegtudományok
2021. OKTÓBER 13.
Az agytérképek csapdába csalhatnak, új reprezentációs keretrendszerre van szükség
A különböző feladatok elvégzéséért felelős agyterületek feltérképezése a területek nagy átfedése miatt nemcsak lehetetlen, de ezt célul tűzni félrevezető is egyben, nyilatkozta a lapnak Lisa Feldman Barrett, a Northeastern University pszichológusa. A tudósok az elmúlt száz évben eredménytelenül keresték a mentális kategóriák: a gondolkodás, az érzékelés, a döntéshozatal, az emlékezés, a mozgás és a többi mindennapos élmény hátterében álló agyterületek közötti határokat, folytatja Barrett, és hozzáteszi: számos közelmúltban megjelent neurológiai vizsgálat is azt bizonyítja, hogy ezek a mentális életet leíró kategóriák nem segítenek annak megértésében, hogyan strukturálódik és hogyan dolgozik az agy. Hibás az az elképzelés, hogy erős párhuzam van az idegkutatók által használt mentális kategóriák és a mentális események neuralis implementációja között, hangsúlyozza a pszichológus.
Központi idegrendszeri vasculitis gyanújával vizsgált betegek vizsgálati eredményeinek retrospektív feldolgozása (OMIII, 2016–2021)
Bevezetés: A központi idegrendszeri (KIR) közép- és nagyérvasculitisek az intracranialis és nyaki artériák gyulladásával járó betegségek, melyek az érfal megvastagodása miatt az artériák szűkületét vagy elzáródását okozhatják. Ezen vasculitisek leggyakoribb tünete az agyi infarktus, az átmeneti agyi keringési zavar és a fejfájás. A primer KIR-vasculitis kizárólag az intracranialis ereket érinti, eredete ismeretlen. A szekunder KIR-vasculitisben az intracranialis erek gyulladása szisztémás kórkép (például SLE, HSV-fertőzés) részeként alakul ki. Célkitűzés: Az OMIII (korábban OKITI) Neurológiai Osztályán KIR-vasculitis iránydiagnózissal kezelt betegek vizsgálati eredményeinek feldolgozása a differenciáldiagnosztikai algoritmus pontosítása céljából. Módszerek: Az intézetünkben 2016. január és 2021. július között KIR-vasculitis gyanújával vizsgált 46 beteg vizsgálati eredményeinek statisztikai feldolgozása. Eredmények: Az akut stroke-ellátás során végzett CTA- és DSA-vizsgálat számos esetben felhívja a figyelmet KIR-i vasculitis lehetőségére. A pontos diagnózis felállításában segít a vasculitisprotokollal végzett koponya- MR- és MRA-vizsgálat. A megadott időszakban összesen 46 betegnél készült vasculitisprotokoll szerint MR- és MRA-vizsgálat. Az UH-val kimutatható halo-jel hasznos noninvazív kiegészítője a képalkotó vizsgálatoknak, ugyanakkor hiánya nem zárja ki a vasculitis lehetőségét. Pozitív halo-jel esetén végzett a. temporalis biopszia az esetek nagy részében alátámasztja a diagnózist. Hat betegnél (13%) láttunk egy vagy két oldali pozitív halo-jelet, ezek közül 3 betegnél lett pozitív a temporalis biopszia. Szérum- és liquorszerológiai vizsgálatok (szérum: HIV, HCV, HBV, VZV, HSV, Treponema pallidum, Borellia burgdorferi, liquor: HSV, VZV, Borellia) szükségesek a szekunder vasculitis kizárásához. A radiológiai vizsgálatok, a rutin labor- és a szerológiai vizsgálatok eredménye alapján 17 betegnél (37%) igazoltunk KIR-vasculitist; minden diagnosztizált beteg szteroid- vagy speciális immunterápiában (rituximab, MTX, cyclophosphamid) részesült. Összefoglalás: A központi idegrendszeri vasculitis lehetséges tünetei a stroke és a TIA-események. A betegség diagnosztizálása fontos, mert ezen betegek esetében a szekunder prevenciós módszerek (thrombocytaaggregáció- gátlás, antikoaguláció, lipidcsökkentés) nem elégségesek, a sikeres kezeléshez immunmoduláns terápia szükséges. A központi idegrendszeri vasculitisek diagnózisához körültekintő klinikai szemlélet szükséges, speciális eszközös vizsgálati módszerek és protokollok alkalmazásával.
Egy igazi autoimmun kihívás – LGI1 autoimmun encephalitis sikeres kezelése Covid mellett
Bevezetés: Az LG1-encephalitis ritka, a feszültségfüggő kálium-csatorna elleni ellenanyag által mediált kórkép, ami leginkább epilepsziás rohamokkal, memóriazavarral, viselkedésváltozással társul. MR-képen a temporalis lebeny és a hippocampus intenzitásváltozása látszódhat. Akut szakaszban plazmaferézis, IVIG-, illetve hosszú távú immunszuppresszáns terápia mellett jó a prognózisa, Covid-19-infekció mellett azonban minden kórkép kezelése kihívásokkal teli, és prognózisa megjósolhatatlan. Esetleírás: 75 éves, diabeteses nőbetegünket zavartság, bizarr viselkedés és beszédzavar miatt vettük fel 2021. 03. 31-én. Neurológiai státuszában kifejezett agitáltság mellett szenzoros túlsúlyú kevert aphasiát észleltünk. Az elvégzett koponya-CT/CTA és -MR kórjelző eltérést nem igazolt. A láztalanság ellenére végzett lumbalpunctio során jelentősen emelkedett fehérjeértéket és mérsékelten emelkedett fehérvérsejtszámot találtunk. Az elvégzett vírus- és baktériumszerológiai, illetve PCR-vizsgálatok kórokozót nem igazoltak. A klinikum alapján felmerült autoimmun encephalitis lehetősége, emiatt empirikusan nagy dózisú szteroidterápiát (7 napig napi 500 mg Solu-Medoll) indítottunk. A kezdeti progressziót mutató globális aphasia fokozatosan szűnt, mérsékelt dezorientáció, kismértékű zavartság maradt vissza. Javuló neurológiai státusz mellett azonban tachy-dyspnoe, deszaturáció jelentkezett, és ugyanaznap igazolódott az LG1-ellenanyag jelenléte és a Covid-19-infekció. Ezt követően párhuzamosan kezeltük a beteg encephalitisét és Covidját Neurológiai Osztályunk Covid-részlegén. Többszörös szövődmények ellenére, a rendelkezésre álló terápiás lehetőségek teljes palettáját alkalmazva, a neurológiai osztály és a társszakmák teammunkája mellett a beteg neurológiai és belszervi állapotát is sikerült rendezni, majd a beteget rehabilitációs kezelést követően otthonába tudtuk bocsátani. A részletes esetismertetését előadásunk tartalmazza. Konklúzió: az LG1-encephalitis többnyire jó prognózisú, adekvát terápia mellett jól kezelhető kórkép. Covid- 19-fertőzés mellett kórházi kezelése rendkívül megnehezül, de jelentős terápiás, illetve emberi erőfeszítések mellett a betegek gyógyulása elősegíthető.
Epilepsziával járó autoimmun encephalitis miatt kezelt betegek klinikai összegzése epilepsziacentrumban
Az autoimmun encephalitisek a kóros, gyakran epilepsziát okozó immunológiai folyamatok széles körét ölelik föl, melyekben számos esetben kimutathatók neuronalis intracelluláris vagy sejtfelszíni antigének ellen termelődő antitestek. A betegség prevalenciáját napjainkban is alábecsülik, a diagnosztikus lépések és a pontos kezelési metodika nem teljesen tisztázott. Célunk az Országos Klinikai Idegtudományi Intézet Epilepszia Részlegén autoimmun encephalitis miatt gondozott betegek egyes alcsoportjai közötti klinikai, radiológiai, pszichopatológiai és elektrofiziológiai különbségek összegzése. Összesen 40 beteget választottunk be vizsgálatunkba; a betegeket a detektált antitestek, a klinikai, radiológiai, elektrofiziológiai szempontok alapján 9 különböző csoportba soroltuk. A legtöbb (n=11) beteg esetében GAD elleni antitestet találtunk, GABA-B receptor elleni antitest a legkevesebb, 1 beteg esetében volt. A legalacsonyabb átlagéletkorral (16,7 év) a posztinfekciós encephalitisszel (FIRES) diagnosztizált betegek, a legmagasabbal (50,4 év) a paraneoplasiás antitesteket termelő betegek rendelkeztek. A társbetegségeket megfigyelve az anti-GAD antitesttel rendelkezők több mint felének autoimmun pajzsmirigybetegsége volt. A vizsgált vasculitisszel diagnosztizált, anti-GABA-B antitesttel rendelkező és Rasmussen-kórban szenvedő betegeknél a koponya-MRI-vizsgálaton a betegségükkel összefüggő eltérés látszott, míg akiknél paraneoplasiás vagy anti-NMDA antitestet detektáltunk, a betegséggel összefüggésben lévő MRI-eltérés nem igazolódott. Az egy csoportba sorolt betegek antiepileptikus, illetve immunszuppresszáns kezelésre adott válasza is hasonló volt. A felszíni antigének ellen termelődött antitesttel bíró betegek esetén jobb volt a terápiás válasz, a leginkább terápiarefrakter betegek a Rasmussen- és a FIRES-csoportba tartoztak. Az autoimmun encephalitis egyes alcsoportjainak fenotípusa hasonló, de a klinikai megnyilvánulás, az EEGés az MR-vizsgálatok átfogó értékelése segíthet egy jól meghatározott rendellenesség diagnosztizálásában. Néhány példát említve, a pajzsimigybetegséggel társuló, MRI-negatív epilepszia hátterében anti-GAD-pozitív encephalitis is állhat. Memóriazavarral, TGA-val járó rosszullétek esetén későbbi életkorban paraneoplasiás mechanizmust is feltételezhetünk, ez segíthet malignus folyamat felfedezésében. Az autoimmun encephalitisben szenvedő betegekre csoportspecifikusan más-más klinikai minták igazak, és egy-egy csoportra különböző terápiás szükséglet, illetve különböző terápiás válasz jellemző. A jövő kihívása többek között a betegség korai felismerése, az encephalitis hátterében álló immunpatológiai folyamatok pontosabb megértése, és a megfelelő időben történő célzott kezelés kidolgozása, melyhez további vizsgálatok szükségesek.
Személyre szabott antiepileptikum-választás
Az epilepszia az egyik leggyakoribb gyermekkori krónikus neurológiai betegség. Az epilepsziás betegek – még az úgynevezett jóindulatú epilepszia esetén is – évekig gyógy-szeres kezelésre szorulnak. Ez idő alatt a gyermekek nagyon nagy változáson mennek keresztül, nemcsak a súlyuk és testmagasságuk gyarapszik, de változnak a hormonális és az anyagcsere-folyamataik is. Életkorok szerint eltérő ütemben zajlanak a különböző agyi területek érési folyamatai is. A mindennapi gyakorlatban az epilepszia diagnózisát követően a legtöbbször a formakör és a rohamtípus alapján választunk gyógyszert. A terápiás stratégia kialakításakor azonban számtalan egyéb tényezőt is figyelembe kell venni: 1. hatékonyság (epilepszia-formakör, rohamtípus), 2. életkor, nem, 3. a gyógyszer farmakológiai tulajdonságai, 4. az adott gyógyszer mellékhatásprofilja, 5. életforma, alkat (kövér, sovány, gyermekközösség), 6. egyéb társbetegségek (etethetőség, viselkedési és tanulási probléma, keringési zavar, vese- vagy májbetegség) 7. a már alkalmazott egyéb gyógyszerekkel várható interakciók, 8. genetika, 9. egyéb szempontok (törzskönyvi szabályok, felírási szokások). A közlemény annak eldöntésében szeretne segítséget nyújtani, hogy a különböző társbetegségek esetén egy adott gyermeknél mely antiepileptikumoktól várható a legkevesebb mellékhatás, és mely készítményeket kellene lehetőség szerint kerülni.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.