Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 148
A poszt-akut Covid-19-beteg ellátása a háziorvosi praxisban
A Covid-19-betegek 10%-a tapasztal elhúzódó gyógyulást. Holisztikus támogatással, pihenéssel, tüneti kezeléssel és az aktivitás fokozatos növelésével legtöbbjük spontán, bár lassan gyógyul. Az új, perzisztens vagy progresszív respiratorikus, cardialis vagy neurológiai tünetek specialista bevonását igényelhetik.
miRNS-alapú terápiák idegrendszeri betegségekben: lehetőségek és kihívások
22 évvel azután, hogy kiderült: bármely gén elcsendesíthető, tucatnyi klinikai vizsgálat elemzi a miRNS-mimetikumok és -inhibitorok terápiás hatását. A módszert az idegrendszeri betegségek közül a neurodegeneratív kórképek, az epilepszia, az agytumorok és a cerebrális ischaemia kezelésében vizsgálják.
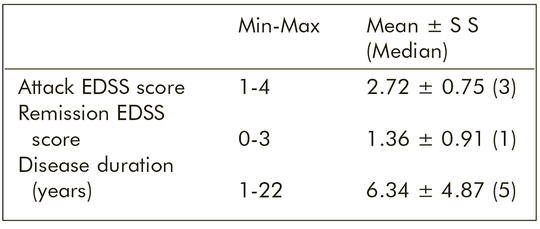
[Mátrix metalloproteinázok és szöveti inhibitoraik relapszáló-remittáló sclerosis multiplexben: lehetséges biomarkerek és kezelési formák]
[A többféle sejttípus által is szintetizált mátrix metalloproteinázok (MMP-k) felelősek a mátrixfehérjék lebontásáért. Az MMP-k endogén szöveti inhibitorai (TIMP-ek) a vér-agy gát állapotának befolyásolásával szerepet játszanak a sclerosis multiplex (SM) patogenezisében. Kutatásunk célja az volt, hogy megvizsgáljuk az MMP-k és a TIMP-ek szerepét az SM immunpatogenezisében és a betegség lefolyásában. Huszonöt, a McDonald-kritériumok szerint diagnosztizált relapszáló-remittáló sclerosis multiplexben szenvedő beteget és 25, korban és nemben illesztett egészséges kontrollszemélyt vontunk be a vizsgálatba. A betegek MMP-9- és TIMP-szintjeit kétszer (roham alatt, illetve remisszióban), míg a kontrollokét egyszer mértük. Az egészséges kontrollokéval összehasonlítva, a betegek MMP-9- és TIMP-szintje a roham alatt, illetve remisszióban, valamint MMP-9/TIMP arányuk egyaránt szignifikánsan magasabb volt. A remissziós periódussal összehasonlítva, a betegek roham alatt mért MMP-9- és TIMP-szintje, valamint az MMP-9/TIMP arány nem mutatott szignifikáns különbséget. Mindazonáltal, a rohamszám alapján képzett alcsoportok eredményei azt mutatták, hogy a két rohammal jellemezhető alcsoport tagjai esetében a remissziós periódussal összehasonlítva, a roham alatt az MMP-9- és TIMP-szintek szignifikánsan magasabbak voltak (p < 0,05). A kettőnél több rohammal jellemezhető alcsoport esetén nem lehetett szignifikáns különbséget kimutatni a remissziós és a rohamos periódus értékei között. A mátrix metalloproteinázok fontos szerepet játszanak az SM immunpatogenezisében, különösen a betegség korai periódusában, és ezen enzimek gátlószerei felhasználhatók az SM terápiájában.]
SARS-CoV-2-immunitás és kapcsolata az oltásokkal
A The Lancet tanulmánya összefoglalja jelenlegi tudásunkat a SARS-CoV-2-fertőzésre adott humorális és celluláris immunválasszal kapcsolatban, és összehasonlítja a természetes, valamint a befogadott, illetve III-as fázisú vizsgálatban lévő vakcinákra adott immunválaszokat.
Agnosztikus terápia onkológiai alkalmazása
A tumoragnosztikus terápia az onkológiai kezelés ígéretes lehetősége, azonban a potenciális célpontok klasszifikálása, validálása, azok egységes módszerek szerinti kimutatása elengedhetetlen. A tumoragnosztikus kezelések engedélyezése új típusú, biomarker-vezérelt klinikai vizsgálatok bevezetését tette szükségessé. Jelenleg három tumoragnosztikus molekuláris célpont ismert: a daganatok magas fokú mikroszatellita-instabilitása (MSI-H), a neurotrop-tirozinkináz-receptor (NTKR) gének fúziója, valamint a daganatok magas tumormutációs terhelése (TMB-H). A pembrolizumab (anti-PD-1 antitest) az első tumoragnosztikus indikációban is törzskönyvezett gyógyszer, amelyet először MSI-H daganatok kezelésére engedélyeztek, majd később a magas TMB is bekerült az indikációk közé. Az NTKR-fúziót hordozó daganatok kezelésére a larotrectinib és az entrectinib került engedélyezésre.
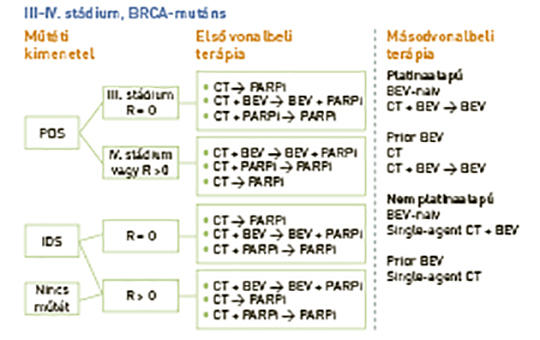
A petefészekrák kezelésének frontvonalában: a PARP-gátlók szerepének megújítása
Kiújult petefészekrákban a poli(ADP-ribóz)polimeráz- (PARP-) gátlókkal történő kezelések megváltoztatták a platinaérzékeny daganatok kezelését. Az új adatok szerint a PARP-gátlókat a kezelési algoritmus korábbi szakaszában kell alkalmazni. A kutatók számba veszik azokat a fázis III vizsgálatokat, amelyekben a PARP-gátlók hatását értékelték újonnan diagnosztizált petefészekrákok primer, illetve fenntartó kezelésében. Megvitatják a gyógyszerek hatásosságát és biztonságosságát az összes daganat, illetve a biomarkerek szerint válogatott daganatok klinikai vizsgálataiban, és összevetik a különböző vizsgálatok előnyeit és korlátait. Fontolóra veszik a jövő kutatásainak prioritásait – különös tekintettel a betegek kiválasztására és a jövőben alkalmazandó, egyelőre hiányzó gyógyszeres regimenek megalkotására. Négy fázis III vizsgálatban (SOLO-1, PAOLA-1/ENGOT-OV25, PRIMA/ENGOT-OV26 és VELIA/GOG-3005) PARP-gátlók használatával (olaparib, niraparib vagy veliparib) a progressziómentes túlélés jelentős javulását figyelték meg petefészekrákos betegekben. A vizsgálatok eltérő kialakítása (kezelés vagy fenntartó kezelés, egy gyógyszeres vagy kombinációs kezelés, bevacizumabbal vagy bevacizumab nélkül), a betegek kiválasztása (műtéti eredmény, biomarkerek elérhetősége, prognózis szerint), a résztvevők eredeti megválasztása (intention-to-treat, BRCA-mutációs vagy homológ rekombinációdeficites pozitív) befolyásolták a vizsgálatokból levonható következtetéseket. A teljes túlélési adatok még függőben vannak, hosszú távú biztonságossági adatok is csak korlátozottan állnak rendelkezésre. A PARP-gátlók sarkalatos szerepet játszanak az újonnan kimutatott petefészekrák-ellátásban, és befolyásolják a további kezeléseket. Ki kell választani azokat a betegeket és gyógyszereket, akiknél az eddigi alkalmazott kezelések a PARP-gátlóknál kevesebb haszonnal járnának.
Tüdőrák harminc év távlatából. Gondolatok a küzdelmes múltról, a jelen eredményeiről és az ígéretes jövőről
Az elmúlt 30 évben a tüdőrák komplex kezelésében óriási fejlődés történt. Ez a fejlődés főként az utóbbi évtizedhez köthető. A tüdőrák kezelésével kapcsolatos nihilizmus már a múlté, realitássá vált az is, hogy az előrehaladott stádiumú betegek is megfelelő kezeléssel gyógyíthatóvá válhatnak, illetve betegségük folyamatos aktív daganatellenes terápia mellett krónikussá szelídíthető. Az előrehaladott stádiumban lévők harminc évvel ezelőtt elérhető 6-8 hónapos várható túlélési mutatói manapság már jelentősen növekedtek, bizonyos esetekben akár az 5 évet is meghaladhatják. Ehhez szükséges a megfelelő diagnosztikus háttér, amely lehetővé teszi a biomarkeralapú kezeléseket. Korai stádiumban alapvető a reszekciós tüdőműtét, beillesztve a komplex terápiás lehetőségeket neoadjuváns és adjuváns formában, illetőleg az új műtéti technikák is hozzájárulnak a terápiás eredmények javulásához. Elmondható ugyanez a sugárterápia vonatkozásában is. A gyógyszeres terápiás lehetőségek tekintetében is a komplex terápiás stratégia érvényesül, melyben alapvető szerepet játszanak a citotoxikus kemoterápiás, célzott kezelési és immunterápiás modalitások. A tüdőrák kezelési stratégiájának felállításában döntő szerepe van a tüdőrák-specifikus onkoteamek működésének. A jövő útját az újabb és újabb célzott terápiás lehetőségek megjelenése, az immunterápiás indikációk bővülése jelezheti a precíziós medicina alkalmazásával. Nem szabad azonban elfeledkeznünk a primer és szekunder prevencióról sem, mely a dohányzás elleni hatékony küzdelmet, illetőleg most már az evidenciává vált rizikócsoportos alacsony dózisú mellkasi CT-szűrés alkalmazását jelenti.
Az immunválasz néhány újonnan felismert hatásmechanizmusa és az immunológia szemléleti átalakulása
Az immunológia az egészséges és kóros immunválaszt tanulmányozó komplex tudomány. Ez az élettani, patofiziológiai tudományág az egyes mechanizmusok megértését elsősorban sejt- és molekuláris biológiai, genetikai, epigenetikai és (neuro)endokrinológiai megközelítéssel, illetve a patológiás folyamatok részleteinek feltárásával végzi. Az immunológia egyike a nagyon gyorsan fejlődő tudományoknak, eredményei visszahatnak más diszciplínákra is elméleti (például hálózattudományok, rendszer-biológia) és módszertani (monoklonális ellenanyagok, biomarkerek, immunoassay-ek) szinten egyaránt. Az immunológusok az elmúlt évtizedekben számos szemléleti változást értek meg, és sok, a hatásmechanizmusokban megnyilvánuló lényegi részletkérdés érvényesülését ismerték fel.
A citokinek fájdalomkeltő szerepe a központi idegrendszerben – az anticitokin-terápia közvetlen analgetikus hatása
A krónikus fájdalom érzékelésében, továbbításában, feldolgozásában és az agyi fájdalomkép megformálásában nociceptiv, neuropathiás és centrális mechanizmusok vesznek részt. A kórokozó jelenlétét vagy a szövetkárosodást jelző és a védekezést riadóztató molekulák, az alarminok kóros folyamatok sorát indítják el, amelyek gyulladásos fájdalomingert váltanak ki. A gyulladáskeltő citokineknek a fájdalom idegrendszeri szinten való megjelenítésében van döntő szerepe. A folyamatos gyulladásos ingerek az idegsejtek perifériás és központi érzékenyítésével aktiválják a fájdalomérzéssel kapcsolatos agyi területeket és kialakítják az összetett fájdalomképet, a fájdalommátrixot. Az agyi funkcionális kapcsolatok hálózatokban működnek és funkcionális MRI-vel képezhetők le. A citokinek a neuronokat közvetlenül, vagy más neuromediátorok révén közvetve aktiválják. A citokinreceptorok megjelennek a nociceptorokon és a magasabb rendű neuronokon is, valamint a különféle nem neuralis sejteken, mint a microglia vagy az astrocyták. Az idegrendszerben szinte mindenütt fellelhető citokinek a tumornekrózis-faktor és az interleukin 6. Jeladási útvonalaik a nukleáris faktor κB és a Janus-kináz enzimrendszere. Ezért a gyulladáskeltő citokinek és a Janus-kináz elsőrendű terápiás célpontok. Az anticitokin biologikumok és a kismolekulájú kinázgátlók rheumatoid arthritisben csökkentik a fájdalmat és javítják a működőképességet. A fájdalomcsökkenés nagyobb, mint ami csak a gyulladás klinikai biomarkereinek csökkenésétől várható lenne. A célzott biológiai és kémiai-biológiai válaszmódosítók korai és gyors fájdalomcsökkentő hatását az agyban kifejtett közvetlen analgetikus hatásnak tulajdonítják.
Glutamát- és szerotonerg mechanizmus magyarázhatja a rapid antidepresszáns hatást
A Nature kiadójának lapjában (Translational Psychiatry) megjelent vizsgálat megmagyarázza a ketamin paradigmaváltást eredményező hatásának mechanizmusát, és biomarkerrel is szolgál a depresszió kezeléséhez.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.