Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 11
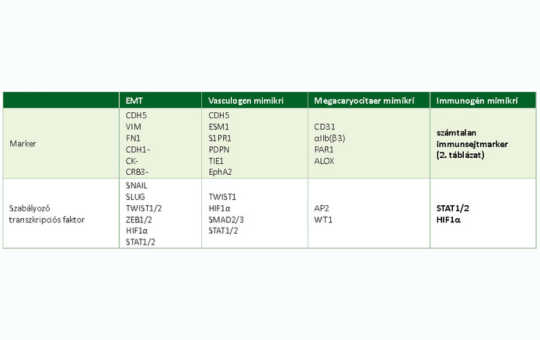
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri
A rosszindulatú daganatok plaszticitása egy fontos új alapvető jellegzetességük, ami a diagnosztikát is zavarhatja, de közrejátszik az áttétképző képesség formálásában is. Továbbmenve, daganataink jelentős részében különféle módon, de kialakul a részleges vagy teljes immunrezisztencia, amelynek alapvető mechanizmusait kezdjük megismerni.
Az immunterápiák pulmonológiai mellékhatásai
Az immuncheckpoint-gátlók megjelenése átírta az onkológiai kezeléseket a szolid tumorok és a hematológiai malignitások esetében is. Ez az áttörés megérkezett a tüdőtumorok kezelésében is.
A perioperatív durvalumab plusz neoadjuváns kemoterápia nagyobb EFS-t és pCR-t eredményez a reszekálható NSCLC-ben szenvedő betegeknél, mint a neoadjuváns kemoterápia önmagában
A reszekálható nem kissejtes tüdőrákban (NSCLC) szenvedő betegeknél a perioperatív durvalumab plusz neoadjuváns kemoterápia a csak neoadjuváns kemoterápiához képest szignifikánsan jobb eredményeket ért el az eseménymentes túlélés (EFS) és a patológiai teljes válasz (pCR) két elsődleges végpontja tekintetében, az egyes szerekkel összhangban lévő biztonsági profil mellett, és nem volt hátrányos hatással a neoadjuváns kemoterápia vagy a műtét befejezésére.
EADO 2023
Az EADO (European Association of Dermato-Oncology – Európai Dermatoonkológiai Társaság) 19. kongresszusa 2023. április 20–22. között az olaszországi Rómában, az Örök Városban került megrendezésre. A személyes jelenléten túl a szervezők virtuálisan, online is hozzáférést biztosítottak a rendezvényhez.
Hírek a világból
Az ismert, hogy az androgének gátolják a T-sejtek IFN-γ-termelését. Kísérleti rendszerben az androgénblokád megemeli az IFN-γ-termelést. Az azonban nem volt világos, hogy befolyásolják-e az mCRPC ICI iránti érzékenységét az androgének. A klinikai kutatásban prosztatabiopsziás mintákat elemeztek, amelyeket egy enzalutamid és pembrolizumab kombinációs klinikai vizsgálatból nyertek. Nyolc beteg mintáját dolgozták fel, ebből három reszponder volt, míg öt nem. A CD8 T-sejtek denzitásában nem volt eltérés a két betegcsoport között a daganatokban. Ugyanakkor a genetikai elemzés kimutatta, hogy a tumorasszociált T-sejteket két csoportra lehetett osztani génexpressziós profil alapján: a reszponderekben citotoxikus gének domináltak, míg a nem reagálók esetében a T-sejtek nyugalmi/blokkolt állapotra jellemzőeket fejeztek ki, ezzel párhuzamosan magasabb volt az androgénszintjük is. A kutatók felfedezték, hogy az IFN-γ-gén promoterében androgénreszponzív elemek vannak. Az enzalutamiddal fel lehetett függeszteni a T-sejtek csökkent IFN-γ-termelését, amit az androgénkezelés váltott ki. Amennyiben az anti-PD1-et enzalutamiddal kombinálták, a T-sejtek különböző funkciói jelentősen javultak. Kísérleti prosztatarákmodellben az enzalutamid és anti-PD1 kombinációs kezelés hatékonyabbnak bizonyult, mint a kétféle terápia önmagában.
Fókuszban
2020. ÁPRILIS 27.
Lehet-e egyenértékű a PD-1, illetve a PD-L1 gátló kezelés?
Számos esetben a tumorok túlélésüket az ún. immun ellenőrzőpontok modulációján keresztül biztosítják, fenntartva ezzel az immunsurveillance és a daganatsejtek proliferációja közti egyensúly eltolódását.
Fókuszban
2020. ÁPRILIS 27.
Van-e hatásosságbeli különbség a PD-1, illetve PD-L1 gátlók között szolid tumorok esetén?
Eredeti közlemény: Duan J, Cui L, Zhao X, et al. Use of immunotherapy With Programmed Cell Death 1 vs Programmed Cell Death Ligand 1 Inhibitors in Patients With Cancer. A Systematic Review and Meta-analysis. JAMA Oncol 2020;6(3):375-84. https://doi.org/10.1001/jamaoncol.2019.5367
A tüdőrák immunterápiája az újabb eredmények tükrében
Tíz évvel ezelőtt az előrehaladott stádiumú tüdőrák esetén, mind a kissejtes (SCLC), mind pedig a nem kissejtes (NSCLC) csoportban, a várható átlagos túlélés egy év körüli volt. Ez, sajnos, az SCLC esetén lényegileg mára sem változott. Az NSCLC kezelésében igazi forradalmi időszakot élünk át. A patológiai alcsoportokra specifikált kombinált citotoxikus kemoterápia mellett igen hosszú túléléssel kecsegtet a célzott terápia (EGFR-mutáció, ALK, ROS1, BRAF-pozitivitás esetén). Az SCLC vonatkozásában a klinikai gyakorlat tekintetében jelentős előrelépés a gyógyszeres kezelésben az utóbbi harminc évben nem történt. Az újabb terápiás lehetőség NSCLC fennállásakor előrehaladott stádiumban az immunellenőrzőpont-gátló terápia, amely három éve már a klinikumban is a komplex kezelés része, hazánkban is. A PD1, a PDL1 és a CTLA4-gátló vegyületek beépítése a terápiás gyakorlatba igazi, új kihívás. Előrehaladott stádiumú NSCLC fennállásakor, magas PDL1-expresszió esetén, első vonalban új standard a pembrolizumab-monoterápia. Második vonalban mind a pembrolizumab, mind a nivolumab, mind pedig az atezolizumab evidenciaalapon adható. Az NSCLC-betegek mintegy harmadát kitevő lokálisan kiterjedt esetekben a radiokemoterápia után alkalmazott konszolidációs fenntartó durvalumab terápia új hatékony lehetőség. Az eddigi gyógyszeres terápiás nihilizmus az SCLC esetén oldódni látszik. Az antitestgyógyszerkonjugátummal végzett terápia alkalmazásának lehetősége már a közeljövőben a klinikumban is várható. A nivolumab, illetőleg a nivolumab + ipilimumab kombináció szintén ígéretes eredményekkel kecsegtet SCLC másod-, illetőleg többedvonalbeli kezeléseként. A biomarker-szelekción alapuló kezelési terv mind NSCLC, mind pedig SCLC esetén részben gyakorlat, részben kutatási irány (például PDL1-expresszió, szomatikus mutációs arány [TMB], DLL3, cMyc stb.). A különböző gyógyszeres kezelési modalitások egyedi alkalmazása helyett az okos, biomarker-szelekción alapuló komplex terápiás stratégia segíthet e betegség eddigi szerény terápiás eredményeinek javításában, krónikus betegséggé való formálásában.
Malignus daganatos megbetegedések okozta neurológiai kórképek
Az onkológiai betegségek okozta neurológiai tünetek, tünetegyüttesek egy szerteágazó etiológiájú heterogén klinikai entitás, amely érintheti a központi és perifériás idegrendszert, lehet primer vagy szekunder, de létrejöhet akár immunmediált folyamatok útján is. Összefoglaló cikkünkben áttekintjük az onkológiai gyakorlatban előforduló neurológiai kórképeket és vezető tüneteket. Kiemelten tárgyaljuk a háttérben álló leggyakoribb daganatként az agyi metasztázisokat, amelyek jelenleg az új célzott és immunterápiák fókuszpontjába kerültek, s napjainkban is egyre bővül azon szerek köre, amelyek intracranialis aktivitást mutatnak. Részletezzük a daganatok okozta paraneoplasiás neurológiai szindrómákat, mert bár ritkák, de egyre jobban diagnosztizálhatók, és gyors felismerésük elengedhetetlen a háttérben álló daganatos folyamat detektálásában. Végül a tumorok kezelésének mellékhatásaként újabban megfi gyelhető neurológiai tüneteket ismertetjük, mint a PD1-gátló immunterápiák következtében közel 3%-ban fellépő neurológiai szövődmények. Nem megfeledkezve a kemoterápiák okozta polyneuropathiákról és a tüneti terápiaként alkalmazott antikonvulzív terápiás indikációkról.
Klinikai Onkológia
2017. MÁJUS 10.
Miért nem hatékonyak az immunellenőrzőpont-gátlók colorectalis carcinomában?
Az elmúlt években kimutatták, hogy az immunellenőrzőpont-gátlók hatásosak különféle malignus daganatok kezelésére, de kevésbé alkalmazhatók colorectalis carcinomában (CRC). Miközben egy egykaros fázis II. klinikai vizsgálatban a CRC mikroszatellit-instabilitást (MSI, vagy MMR-defi ciens, mismatch repair defi - cient) mutató alcsoportja közepes mértékű válaszreakciót mutatott a pembrolizumabra, a mikroszatellit-stabil (MSS) tumorok nem reagáltak rá. Ebben a cikkben a CRC-ben az immunválaszt lehetségesen befolyásoló mechanizmusok kerülnek áttekintésre, hogy a hiszton-deacetiláz (HDAC) -gátlás visszafordíthatja-e az előrehaladott CRC-k esetén gyakran észlelt immunológiai editálást, és visszaállítja-e az immunellenőrzőpont-blokáddal szembeni szenzitivitást.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.