Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 17
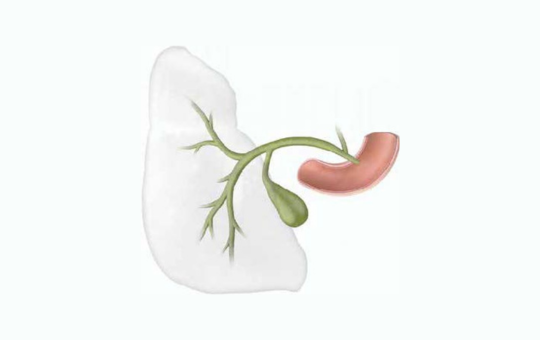
Epehólyag- és epeúti daganatok kezelése
Az epeeredetű daganatok (BTC-k: epehólyagrák, intrahepaticus és extrahepaticus epeúti daganat) olyan heterogén rosszindulatú daganatok, amelyek jelentősen eltérő epidemiológiai, klinikai és molekuláris jellemzőkkel rendelkeznek.
EADO 2023
Az EADO (European Association of Dermato-Oncology – Európai Dermatoonkológiai Társaság) 19. kongresszusa 2023. április 20–22. között az olaszországi Rómában, az Örök Városban került megrendezésre. A személyes jelenléten túl a szervezők virtuálisan, online is hozzáférést biztosítottak a rendezvényhez.
Hepatocellularis carcinomás beteg sikeres májátültetése TACE- és sorafenibkezeléssel elért tumorméret-csökkentés után. Társszakmák sikeres együttműködése
Az eset példa arra, hogy inoperábilis hepatocellularis májrák (HCC) esetén lehetséges a tumor megkisebbítése és a májátültetés. Hangsúlyozzuk, hogy a HCC-ben szenvedő betegek ellátásában fontos a társszakmák együttműködése. Lényeges, hogy olyan intézetekbe irányítsák a beteget, ahol a potenciálisan szóba jövő kezelések teljes skálája elérhető, valamint az alap májbetegség követése, ellátása is megtörténik.
A célzott kezelések „célzott” mellékhatásai
A célzott gyógyszerek nem elég célzottak, gyakran a normális gének termékeire is hatnak, vagy nem elég szelektívek a mutáns változatokra, így egyáltalán nem elhanyagolható és sajátos mellékhatásaik vannak, aminek patomechanizmusát érdemes ismerni, mert általa a mellékhatások megelőzése vagy „célzott” kezelése lehetséges. Miután a célzott kezelések molekuláris mechanizmusai igen eltérők, ezen mellékhatások spektruma is széles és nagyon eltérő a hagyományos kemoterápiás szerekhez hasonlítva. Az angiogenezisgátlók mellékhatásai a VEGF-mediált folyamatok zavarai (vérzés, sebgyógyulás, vérnyomás-szabályozás), a csontáttét kezelésében használt szerek csontregenerációs zavarokhoz vezetnek az osteoclastfunkció blokkolásával, a HER-2-gátlók szelektív szívizom-károsítók lehetnek, mert ez a receptor kulcsfontosságú az izomregenerációban. Mivel az EGFR a felszíni hám folyamatos megújulásának fő szabályozója, az anti-EGFR-szerek bőrmellékhatásai csaknem természetesek. A multikináz-inhibitorok két fontos célpontja a csontvelő (a KIT kulcsszerepe miatt), illetve a melanocita (hasonló okokból). Az új TRK-inhibitorok esetében idegrendszeri mellékhatások léptek fel, miután az idegsejtek fontos szabályozója az NTRK. A mutáns BRAF-inhibitorok, sajnos, csak szelektívek, és alkalmazásuk során másodlagos, elsősorban RAS-mutáns daganatok keletkezése várható a RAS-RAF-MEK jelpálya sajátos visszacsatolási reakciói eredményeként. A lipidkináz-jelpálya különböző inhibitorai (PI3K, AKT vagy mTOR) megint csak jellegzetes mellékhatásokkal járnak, mint a hyperglykaemia vagy a hyperlipidaemia. Végül az immunellenőrzőpont-gátlók a daganatellenes immunválasz felszabadítása mellett, eddig kontroll alatt levő autoimmun mechanizmusokat is aktiválnak, amelyek adott esetben súlyosak is lehetnek vagy eddig még nem ismert formában manifesztálódnak (hypophysitis).
A kezelések sorrendje áttétes colorectalis rákban
Az áttétes colorectalis rák (mCRC) a legtöbb esetben gyógyíthatatlan állapot, de a beteg élettartama a korszerű kemoterápiás és célzott gyógyszeres kezelésekkel meghosszabbítható. Ugyanakkor nem teljesen tisztázott, hogy ezeket a gyógyszereket a kezelés különböző vonalaiban milyen optimális sorrendben kellene használni. A tanulmányban számba veszik a jelenleg rendelkezésre álló kezeléseket és az optimális kezelési sorrendet az mCRC első, második és harmadik választású ellátása során, de érintik a kezelési sorrendet és a kezelések átértékelését befolyásoló biológiai aspektusokat is. A hatásos első vonalú kezelés kulcsszerepet játszik a betegség végső kimenetelének alakulásában, ezért a különböző klinikai faktorok és biológiai markerek – mint a RAS és a BRAF – ismeretében kell azt megválasztani. A második vonalban alkalmazandó kezelés az első vonalban adott szisztémás kezeléstől függ. A legtöbb betegnél antiangiogén kezelések (például bevacizumab, ramucirumab és afl ibercept) bevezetése is indokolt, míg az epidermalis növekedési faktor receptor (EGFR-) gátlás alkalmazása a második vonalban nem hosszabbítja meg az élettartamot. Harmadik vonalban nagyon fontos a molekuláris profil ismerete, a vad típusú RAS-t mutató daganatos betegeknél EGFR-gátlókat (cetuximab vagy panitumumab) tartalmazó regorafenib és trifl uridin/tipiracil kezelést alkalmaznak. A pembrolizumabbal vagy nivolumabbal ± ipilimumabbal végzett immunkezelést szükséges megfontolni a magas mikroszatellita-instabilitást mutató betegségben. A HER2/neu amplifikációt megcélzó kezelések sikeresek lehetnek az ilyen abnormitást mutató colorectalis tumoros esetekben. A kezelések sorrendjének eldöntését tovább bonyolítják a kezeléseknek a daganatos progresszió eltérő jellege miatt szükségessé vált megszakításai vagy beszűkítései. Jelenleg is vizsgálják mCRC-s betegeken a kezelések optimális sorrendjét és azok optimális ütemezését. A molekuláris profilok megismerésével új targeteket lehet kijelölni, ráadásul egyre jobban kezdjük megérteni a daganatoknak a gyógyszerhatások alatt bekövetkező folyamatait, amelyek végül befolyásolhatják a kezelési sorrendet is.
Az ANTI-PD-1-kezelés hatásossága és az életkor közötti kapcsolat
A citotoxikus T-lymphocyta-asszociált protein-4 (CTLA-4) és a programozott sejthalálreceptor-1 (PD-1) ellenőrzőpont-gátló immunkezelések egyaránt hatásosak BRAF-mutáns és vad típusú melanomában, továbbá tartós betegségkontrollt eredményezhetnek. A daganaton belüli immunsejtek mennyisége és működése befolyásolja a terápiás választ.
A tüdőrák immunterápiája az újabb eredmények tükrében
Tíz évvel ezelőtt az előrehaladott stádiumú tüdőrák esetén, mind a kissejtes (SCLC), mind pedig a nem kissejtes (NSCLC) csoportban, a várható átlagos túlélés egy év körüli volt. Ez, sajnos, az SCLC esetén lényegileg mára sem változott. Az NSCLC kezelésében igazi forradalmi időszakot élünk át. A patológiai alcsoportokra specifikált kombinált citotoxikus kemoterápia mellett igen hosszú túléléssel kecsegtet a célzott terápia (EGFR-mutáció, ALK, ROS1, BRAF-pozitivitás esetén). Az SCLC vonatkozásában a klinikai gyakorlat tekintetében jelentős előrelépés a gyógyszeres kezelésben az utóbbi harminc évben nem történt. Az újabb terápiás lehetőség NSCLC fennállásakor előrehaladott stádiumban az immunellenőrzőpont-gátló terápia, amely három éve már a klinikumban is a komplex kezelés része, hazánkban is. A PD1, a PDL1 és a CTLA4-gátló vegyületek beépítése a terápiás gyakorlatba igazi, új kihívás. Előrehaladott stádiumú NSCLC fennállásakor, magas PDL1-expresszió esetén, első vonalban új standard a pembrolizumab-monoterápia. Második vonalban mind a pembrolizumab, mind a nivolumab, mind pedig az atezolizumab evidenciaalapon adható. Az NSCLC-betegek mintegy harmadát kitevő lokálisan kiterjedt esetekben a radiokemoterápia után alkalmazott konszolidációs fenntartó durvalumab terápia új hatékony lehetőség. Az eddigi gyógyszeres terápiás nihilizmus az SCLC esetén oldódni látszik. Az antitestgyógyszerkonjugátummal végzett terápia alkalmazásának lehetősége már a közeljövőben a klinikumban is várható. A nivolumab, illetőleg a nivolumab + ipilimumab kombináció szintén ígéretes eredményekkel kecsegtet SCLC másod-, illetőleg többedvonalbeli kezeléseként. A biomarker-szelekción alapuló kezelési terv mind NSCLC, mind pedig SCLC esetén részben gyakorlat, részben kutatási irány (például PDL1-expresszió, szomatikus mutációs arány [TMB], DLL3, cMyc stb.). A különböző gyógyszeres kezelési modalitások egyedi alkalmazása helyett az okos, biomarker-szelekción alapuló komplex terápiás stratégia segíthet e betegség eddigi szerény terápiás eredményeinek javításában, krónikus betegséggé való formálásában.
MEK és ERK - RAS és RAF ellen
A célzott terápia kezdeti klinikai hatása után a legtöbb esetben a tumor rezisztenssé válik a kezeléssel szemben, aminek megfordítása jelenleg az egyik legnagyobb probléma a klinikai onkológiai gyakorlatban. Ennek a szekunder rezisztenciának sok oka lehet, pl. új driver mutáció jelenik meg a kezelt tumorban, az eredeti célponttól eltérő hibát tartalmazó klón lesz a meghatározó, a tumorsejtek funkcióinak, elsősorban proliferációjának szabályozását egy másik jelút veszi át. (Az sem közömbös, hogy a célzott terápiára lokálisan előrehaladt és/vagy metasztatikus tumorok esetében kerül sor.) Ilyen változások igen gyakoriak a RAS-RAF-MEK-ERK jelátviteli úton. A zavarokat főleg mutációk okozzák, és vezetnek a tumorsejtek korlátlan szaporodásához, terjedéséhez. Az egyik kulcsproblémát a RAS mutációi jelentik, amelyek befolyásolása ma még megoldatlan. A leggyakoribb BRAF leggyakoribb mutációját gátlószerekkel sikerült átmeneti klinikai választ elérni, főleg melanomákon. Felmerült, hogy a kóros jelátvitel megakadályozását a jelúton a MEK és/vagy ERK gátlásával lehetne elérni, hiszen ezek aktivitása a fenti hibák miatt fokozottá válik. Ezek a próbálkozások a logikus elgondolás ellenére áttörő sikert még nem értek el. Ez az összefoglaló elsősorban a MEK-kel kapcsolatos eredményeket, a további lehetőségeket tekinti át.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.