Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Klinikai Onkológia - 2018;5(04)
Tartalom
Tapasztalatok – ESMO 2018
A Münchenben megrendezett ESMO 2018 konferencia során idén is számtalan kivételes vizsgálati eredményt mutattak be válogatott előadók a világ minden tájáról. Egyik központi téma volt az immunterápiák szerepe és pontos helye az aktuális standard terápiás lehetőségek között. A következő oldalakon a nemzetközi szervezetek által is kiemelkedően fontosnak tartott tanulmányokból válogattunk a teljességre törekedve.
Génexpressziós profilok a korai emlőrák adjuváns kezelésében
Az emlőrák különböző molekuláris biológiai sajátosságú és klinikai lefolyású alcsoportokra tagolódó heterogén betegség. Hagyományosan klinikai, patológiai jellemzők alapján határozzuk meg a korai emlőrákok kezelési stratégiáját, habár annak megítélése, hogy kinek előnyös az adjuváns szisztémás terápia, továbbra is nagy kihívás, és a betegek gyakran indokolatlan alul- vagy túlkezeléséhez vezet. A korai emlőrákos betegek kockázatelemzése támogatja az adjuváns kemoterápiás döntéshozatalt. Az alábbi áttekintő közlemény részletesen bemutatja hét, kereskedelmi forgalomban elérhető multigén assay kifejlesztését, validációját, amelyeknek célja, hogy hasznos prognosztikus és lehetőség szerint prediktív információkat nyújtson a korai stádiumú emlőrákos betegekről. A szerzők a tesztek analitikai, klinikai validitása és klinikai hasznossága részletes elemzését éppúgy, mint a klinikai alkalmazásukat igazoló evidenciák, összehasonlító és költséghatékonysági vizsgálatok eredményeit ismertetik.
A fej-nyak daganatok modern kezelése
A fej-nyak daganatok világszerte jelentős egészségügyi problémát jelentenek. A terápiás modalitások nagymértékű fejlődése ellenére prognózisa az utóbbi évtizedekben nem változott. Kialakulásában a klasszikus rizikófaktorok, az alkoholfogyasztás és dohányzás játszanak szerepet, azonban a szájgaratdaganatok jelentős részét HPV-infekció okozza, amelyre jellemző egy új betegcsoport, jobb prognózis és terápiás válasz. A kivizsgálás magába foglalja a stagingvizsgálatokat (CT, MR, FDG-PET), amelyek alapján oncoteam szükséges a terápiás döntéshez. Ezt a beteg preferenciája jelentősen befolyásolhatja. Korai vagy lokálisan előrehaladott daganatokban a terápia multimodális, műtét, sugárkezelés, kemoirradiáció, kemoterápia, illetve ezek kombinációja jön szóba. A target terápiák közül az EGFR-gátlók használata hasznos, részben recidiváló/metasztatikus vonalban, részben sugárterápiával kombinálva. Az immunellenőrzőpontgátlók egy új terápiás lehetőséget jelentenek előkezelt, recidiváló/metasztatikus betegségben, szerepüket vizsgálják korábbi terápiás vonalakban is. A HPV-pozitív daganatok esetében több klinikai vizsgálat irányul a kezelés dezintenzifi kálására. Molekuláris genetikai vizsgálatokkal alcsoportokat próbálnak meghatározni a kezelés individuálisabb megtervezésére. Tekintettel arra, hogy a betegség és a kezelés jelentős funkcionális és esztétikai károsodással járhat, a szupportív kezelésnek, rehabilitációnak kiemelkedő szerepe van.
Előremutató terápiák kasztrációrezisztens áttétes prosztatarákban
Bevezetés: A prosztatarák világszerte a második leggyakoribb daganatos betegség, és az Európai Unióban az 50 fölötti férfi ak leggyakrabban diagnosztizált daganata. Változatlanul az androgéndeprivációs terápia a kiújult vagy áttétes betegség kezelésének alapja. Szerencsétlen módon viszont csaknem az összes beteg rezisztenssé válik az androgénblokáddal szemben, és kialakul a „kasztrációrezisztens prosztatarák” (CRPC) képe. Az utóbbi 10 évben az új kezelési lehetőségeknek köszönhetően drámaian javult az áttétes CRPC-ben (mCRPC) szenvedő férfi ak túlélése. A legmodernebb terápiák az AR-axis-gátlók és a taxánalapú kemoterápiák, valamint a radiofarmakonok és a sipuleucel T. Az érintett területek: A szerzők az áttétes CRPC legújabb szisztémás kezelési lehetőségeit tárgyalják. Ezután a legújabb kezelések részletes analízise következik, és tárgyalják az új terápiák alapját képező biológiai okokat. Szakértői vélemény: Mivel számos vizsgálat igazolta, hogy a docetaxel és az új hormonális szerek meghosszabbítják az áttétes CRPC-ben szenvedők, valamint a nem áttétes CRPC-ben szenvedők élettartamát, várható, hogy a betegek egyre növekvő alcsoportjában korán lehet kemoterápiát és az AR-t célzó anyagokkal végzett kezeléseket elindítani. Alapvető, hogy találjunk új stratégiákat a gyógyszer-rezisztencia legyőzésére, amellyel tovább javulhat a betegek túlélése.
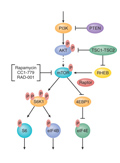
PI3K–AKT–mTOR-jelút gátlása mint terápiás célpont
A PI3K-AKT-mTOR az egyik legforgalmasabb út a sejtjeinkben, jelek fogadásával és továbbadásával, átkapcsolásaival (RAS-út, ligandok), beépített gátlóival (PTEN) a sejtműködés szabályozásának kulcseleme. Ehhez a sejttípusonként eltérő bonyolult rendszerhez megfelelően komplex szabályozás társul. A szabályozásban szereplők hibái (mutáció, amplifikáció, deléció) daganatok kialakulásához vezethetnek, egyben a tumorellenes terápiák fontos célpontjai lehetnek. Engedélyt klinikai alkalmazásra eddig csak négy szer kapott. Ennek a csalódást okozó eredménynek a hátterében számos probléma húzódhat meg. Ilyen a biomarker hiánya, ami a betegek kiválasztását tehetné hatékonyabbá, a grade 3-4 toxicitási mellékhatások magas aránya, a terápiás szer pontatlansága, de az is felvethető, hogy a támadott célpontok nem a daganat meghatározó mozgatói, nem driverhibák. Az a tanulság biztosan levonható, hogy értékelhető klinikai válasz csak kombinált kezeléstől várható.
A marihuána orvosi felhasználásának onkológiai szempontjai
A marihuána orvosi felhasználása napjainkban a magyar onkológiai betegek széles körében jelentős érdeklődésre tart számot. A gyakorló onkológus ezért a mindennapi klinikai munkában egyre többször találja szemben magát a kannabinoidokkal kapcsolatos kérdésekkel. A cikkben néhány alapfogalom tisztázására, a külföldi és a hazai hozzáférési helyzet bemutatására kerül sor. Számtalan közlemény foglalkozik a marihuána alkalmazásával rákbetegeknél, különböző indikációkban. A közleményekben a daganatos javallati körben legtöbbször a kemoterápia okozta hányinger és hányás, a krónikus fájdalom, az alvászavarok, az étvágytalanság és a fogyás szerepelnek. A cikk kitér a rosszindulatú daganatok oki kezelésével kapcsolatos ismeretekre is, amelyek jelenleg a glioblastomára korlátozódnak. A kannabisz rákkeltő hatásával kapcsolatos kérdésekről, illetve amerikai onkológusok körében végzett ismertség és attitűdértékelésről is nyújt információt ez a cikk, amelyben a fenti témájú közlemények irodalmi áttekintésére kerül sor.
Új generációs szekvenálás diagnosztikai felhasználása az onkológiában
Napjainkban az információ az egyik legnagyobb kincs, alkalmas a meglévő tudás rögzítésére és használata, elemzése a fejlődés alapja. A természetben, az élő rendszerek - és a vírusok - szintjén is kialakult az információ megőrzésének biokémiai módja. A lineáris kódolás olyan makromolekulákat igényel, amelyek képesek megszámolható változattal rendelkező építőegységekből kombinációsorozatokat rögzíteni. Ezeket szoktuk lineáris információhordozó makromolekuláknak is nevezni. Ilyen láncok például a fehérjék és a nukleinsavak. Az onkológia területén kiemelten fontos a tumorsejtek genetikailag kódolt képességeinek meghatározása és elemzése. A tumort alkotó klónok genomjában lévő öröklött vagy szerzett eltérésekhez kapcsolható funkciók teszik lehetővé az ilyen sejtek túlélését, de egyben feltárják a támadható mechanizmusokat és azok kiemelt pontjait is. Az új generációs szekvenálás onkodiagnosztikai felhasználása leggyakrabban a tumorkialakulással és túléléssel kapcsolható génkészlet vizsgálatára terjed ki. Ez a kialakult panel ezzel a technológiával elég fejlett ahhoz, hogy bekerüljön a rutindiagnosztikába, de kiemelten fontos az in vitro diagnosztikai (IVD) feltételrendszer minőségi és standardizációs követelményeinek a biztosítása.
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.