Az eLitMed.hu orvostudományi portál a böngészés tökéletesítése érdekében cookie-kat használ.
Ha bővebb információkat szeretne kapni a cookie-k használatáról és arról, hogyan módosíthatja a beállításokat, kattintson ide: Tájékoztató az eLitMed.hu Cookie-használatáról.
Részletes keresés
Kérjük, állítsa be a paramétereket!
Találatok száma: 30
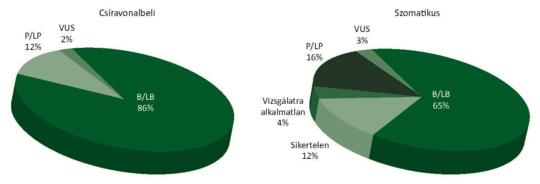
A BRCA1- és BRCA2-mutációk kockázati szerepe a szolid daganatok kialakulásában
A BRCA1- és BRCA2-mutációk kiemelkedő jelentőséggel bírnak a szolid tumorok, különösen az emlő- és petefészekrák kialakulásában.
Az immunterápiák pulmonológiai mellékhatásai
Az immuncheckpoint-gátlók megjelenése átírta az onkológiai kezeléseket a szolid tumorok és a hematológiai malignitások esetében is. Ez az áttörés megérkezett a tüdőtumorok kezelésében is.
Út a szívhez a vesén át. A residualis cardiovascularis rizikó csökkentésének újabb távlatai – a mesodermalis eredetű szervek kommunikációs útvonalai és mediátorai
A cardiovascularis betegségek továbbra is magas morbiditási adatai a ”maradék” rizikótényezők feltárását indokolják. Az embrionális fejlődés folyamán a cardiovascularis szervek a mesodermából fejlődnek ki, a sejtvonalak között fennmaradó humorális és mechanikus kommunikáció részben magyarázatot ad a maradék cardiovascularis rizikó jelenségére, részben pedig új terápiás célpontok körvonalazódásához vezet.
Immunellenőrzőpont-gátló terápiák okozta bőrmellékhatások
Az elmúlt évtizedben az immunellenőrzőpont-gátlók (ICI) megjelenésével az onkológiai betegek ellátása jelentős változáson ment keresztül. Ezen új terápiás szerek megjelenésével új mellékhatásprofilt is meg kellett tanulnunk.
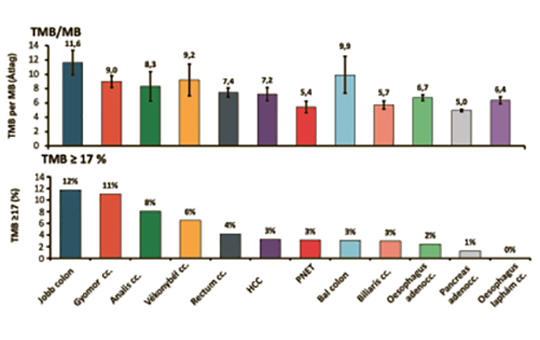
Biomarkerek szerepe a gastrointestinalis daganatok kezelésében
Összefoglaló – A komprehenzív molekuláris profilvizsgálatokon, a bioinformatika fejlődésén alapuló precíziós onkológiai megközelítés, célzott terápia és immunellenőrzőpont-inhibitorok (immune checkpoint inhibitors – ICI) gyökeresen változtatta meg az onkoterápia eredményeit. Az előrehaladott, metasztatikus stádiumú emésztőrendszeri daganatokban szenvedő betegek kedvezőtlen túlélési esélye jelentősen javult az új terápiás lehetőségek alkalmazásától. A sikeres terápia azonban számos molekuláris jellemző ismeretét, meghatározását igényli – PD-L1 expresszió, MSI (mikroszatellita-instabilitás)/dMMR (mismatch repair deficiency), TMB (tumor mutational burden), rezisztenciamutációk, genetikai variánsok jelenléte. Jelen összefoglaló célja áttekintést adni a gastrointestinalis (GI) traktus rosszindulatú daganatainak precíziós onkológiai szemléletű kezelésében alkalmazható prediktív és prognosztikus biomarkerek szerepéről, jelentőségéről.
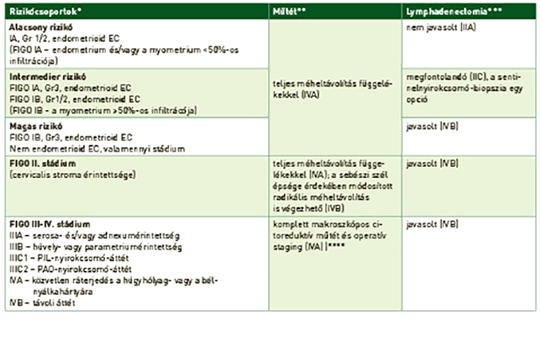
A méh rosszindulatú daganatainak korszerű onkológiai kezelése
Világviszonylatban évente közel 400 000 nőnél igazolódik méhtestrák, amely 2018-ban körülbelül 90 000 nő halálát okozta. Az esetek túlnyomó részét a méhnyálkahártya hormonérzékeny hámjából kiinduló endometriumcarcinomák (EC) alkotják. A sarcomák a méhtestrákok alig 3%-át adják. Az EC-k 80-85%-a jó prognózisú, mivel alacsony gradusú és korai stádiumban kerül felismerésre, amikor a műtét és az esetleges posztoperatív kezelés révén a gyógyulás reális terápiás cél. Az előrehaladott stádiumban diagnosztizált EC és a nem endometrioid altípusok esetén a prognózis lényegesen rosszabb. A magas rizikójú EC optimális adjuváns kezelésére irányuló vizsgálatok egy része még folyamatban van, illetve a bővülő molekuláris ismeretek újabb vizsgálatokat generálnak. A méhtestsarcomák esetében is a sebészi eltávolítás jelenthet kuratív megoldást, az adjuváns kezelésre vonatkozó evidenciák bizonytalanok, egyéni mérlegelést igényelnek. A modern onkoterápia érájában már nemcsak a betegségmentes élet meghosszabbítására, hanem az élet minőségének minél teljesebb megőrzésére is törekszünk. A nőgyógyászati onkológiában ezt jelenti a fertilitás vagy a funkcionáló ováriumok lehetőség szerinti megőrzése; a magas morbiditással járó szisztémás lymphadenectomia indikációs körének szűkítése; a kedvezőbb mellékhatásprofilú brachytherapia alkalmazása a teljes kismedencei besugárzás helyett. A modern onkoterápia az úgynevezett biológiai kezelések által az előrehaladott betegségek ellátásának is a részévé vált: kemoterápia mellett/után progrediáló esetekben a pembrolizumab az EC és a sarcomák esetén is alkalmazható mikroszatellita-instabilitás vagy magas tumormutációs terheltség esetén, míg az NTRK fúziós gén jelenlétében larotrectinib vagy entrectinib mint célzott tirozinkináz-gátlók javasolhatók. Az EC-k 70-80%-át kitevő mikroszatellita-stabil esetekben (nem endometrioid altípusokban is!) a pembrolizumab lenvatinibbel kombinációban adható a kemoterápia után. Az EC területén gyarapodnak továbbá az egyéb célzott terápiás szerekkel szerzett tapasztalatok is (anti-HER2 serosus carcinomában, mTOR-gátló kezelés, endokrin terápia, más immun checkpoint inhibitorok, tirozinkináz-gátlók, PARP-gátlók és kombinációs kezelések). A jelen munka a méhtestrákok onkoterápiájáról kíván rövid összefoglalást nyújtani az aktuális szakmai ajánlások és a folyamatban lévő vizsgálatok bemutatásával.
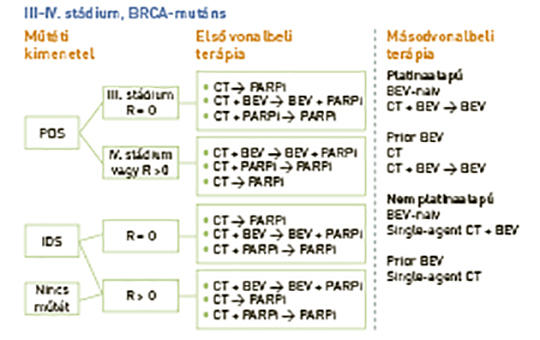
A petefészekrák kezelésének frontvonalában: a PARP-gátlók szerepének megújítása
Kiújult petefészekrákban a poli(ADP-ribóz)polimeráz- (PARP-) gátlókkal történő kezelések megváltoztatták a platinaérzékeny daganatok kezelését. Az új adatok szerint a PARP-gátlókat a kezelési algoritmus korábbi szakaszában kell alkalmazni. A kutatók számba veszik azokat a fázis III vizsgálatokat, amelyekben a PARP-gátlók hatását értékelték újonnan diagnosztizált petefészekrákok primer, illetve fenntartó kezelésében. Megvitatják a gyógyszerek hatásosságát és biztonságosságát az összes daganat, illetve a biomarkerek szerint válogatott daganatok klinikai vizsgálataiban, és összevetik a különböző vizsgálatok előnyeit és korlátait. Fontolóra veszik a jövő kutatásainak prioritásait – különös tekintettel a betegek kiválasztására és a jövőben alkalmazandó, egyelőre hiányzó gyógyszeres regimenek megalkotására. Négy fázis III vizsgálatban (SOLO-1, PAOLA-1/ENGOT-OV25, PRIMA/ENGOT-OV26 és VELIA/GOG-3005) PARP-gátlók használatával (olaparib, niraparib vagy veliparib) a progressziómentes túlélés jelentős javulását figyelték meg petefészekrákos betegekben. A vizsgálatok eltérő kialakítása (kezelés vagy fenntartó kezelés, egy gyógyszeres vagy kombinációs kezelés, bevacizumabbal vagy bevacizumab nélkül), a betegek kiválasztása (műtéti eredmény, biomarkerek elérhetősége, prognózis szerint), a résztvevők eredeti megválasztása (intention-to-treat, BRCA-mutációs vagy homológ rekombinációdeficites pozitív) befolyásolták a vizsgálatokból levonható következtetéseket. A teljes túlélési adatok még függőben vannak, hosszú távú biztonságossági adatok is csak korlátozottan állnak rendelkezésre. A PARP-gátlók sarkalatos szerepet játszanak az újonnan kimutatott petefészekrák-ellátásban, és befolyásolják a további kezeléseket. Ki kell választani azokat a betegeket és gyógyszereket, akiknél az eddigi alkalmazott kezelések a PARP-gátlóknál kevesebb haszonnal járnának.
A RAAS-gátlók pozitív hatása COVID-19-betegek körében
A metaanalízis célja annak megállapítása volt, hogy milyen hatással bírnak a hipertenzív, illetve bármely egyéb okból RAAS-gátlót szedő COVID-19-betegek morbiditására és mortalitására a SARS-CoV-2 vírus sejtbe lépését esetlegesen befolyásoló szerek.
Fókuszban
2020. ÁPRILIS 27.
Van-e hatásosságbeli különbség a PD-1, illetve PD-L1 gátlók között szolid tumorok esetén?
Eredeti közlemény: Duan J, Cui L, Zhao X, et al. Use of immunotherapy With Programmed Cell Death 1 vs Programmed Cell Death Ligand 1 Inhibitors in Patients With Cancer. A Systematic Review and Meta-analysis. JAMA Oncol 2020;6(3):375-84. https://doi.org/10.1001/jamaoncol.2019.5367
A renin-angiotenzin-aldoszteron rendszert gátló gyógyszerek és a Covid-19 kockázata
A közlemény eredményei alapján, az 5 vizsgált, leggyakrabban alkalmazott vérnyomáscsökkentő gyógyszercsoport közül egyik sem növelte jelentősen a pozitív Covid-19 tesztnek a valószínűségét, illetve, hogy a pozitív teszteredményű betegek között súlyosabb lesz a betegség lefolyása.
1.
2.
3.
4.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.