Az étrend és a gasztrointesztinális endokrin sejtek közti interakció
2016. SZEPTEMBER 06.
2016. SZEPTEMBER 06.
Szöveg nagyítása:
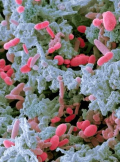
A gasztrointesztinális endokrin sejtek létfontosságúak. Szabályozzák a gasztrointesztinális traktus (GIT) motilitását, szekrécióit, viszcerális érzékenységét, az aboszorpciót, a sejtproliferációt és az étvágyat is. Ezek a sejtek szenzoros sejtekként működnek és a GIT bennék tartalmát (főleg tápanyagok és bakteriális termékek) érzékelve ezen luminális stimulusokra adnak szekréciós választ azzal, hogy hormonokat bocsátanak a lamina propriába. Amennyiben a véráramba bekerülnek és távoli célpontjaikon fejtik ki hatásukat, úgy nemcsak helyi, vagyis parakrin funkciójuk van, hanem emellett, endokrin (szisztémás) funkciót is ellátnak. Mindezek mellett nem szabad elfelejtkezni arról sem, hogy működni képesek afferens és efferens szinaptikus transzmisszió útján is. Értelemszerűen mindig attól függ, hogy melyik hormonról van szó. A szekréciók fontosabb szabályozási pontja, de nem az egyetlen, az az elfogyasztott táplálék tovahaladása a GIT-ben, az emésztés gasztrikus és intesztinális fázisai. Az étrend megváltoztatása nem csupán a GIT hormonok felszabadulásaira van hatással. Hanem egyúttal befolyásolja az endokrin sejtdenzitást is. Ennek a kapcsolatnak az ismerete hasznos lehet a klinikumban, különösen ha olyan GIT-et érintő, vagy metabolikus betegségeket kezelünk, mint amilyen az IBS, elhízás, vagy cukorbetegség. Ismert, hogy a GIT eltérő szegmenseiben számos, különféle endokrin sejtpopuláció van. Néhány közülük csak speciális helyen fordulnak elő, némelyek pedig mindegyik részét érintik. Például a szerotonin és a szomatosztatin szekréciós sejtjei megtalálhatóak a gyomorban, a vékonybélben és a vastagbélben is, ugyanakkor a ghrelin és a gastrin csak a gyomorban. A szekretin, a CCK (kolecisztokinin-pankreozimin), a GIP, a motilin, ezek mind a vékonybél felső szakaszán szekretálódnak. Az, hogy melyik szekréciós sejt milyen mennyiségben, vagy együtt nézve melyik milyen arányban fordul elő a maga helyén, nem elhanyagolható kérdés. Ezeknek a sejteknek eltérő az előfordulása a GIT egyes szekcióiban, de legalábbis meghatározott ott, ahol előfordul. A sejtdenzitás például a duodenumban a legmagasabb. Fontos, hogy egymással is kapcsolatban állnak, nem csak az enterális idegrendszerrel (ENS), vagy a központi idegrendszerrel (CNS). A GIT intraluminális tartalma, legfőképpen szénhidrátok, proteinek és zsírok, triggerelik a különféle jelzőanyagok/molekulák (pl. hormonok) felszabadulását az endokrin sejtekből. Ugyanakkor az elfogyasztott táplálék egyben prebiotikum is lehet a bélflóra számára. A keletkező bakteriális termékek befolyással bírnak egy részről szintén, a hormonok felszabadulására, más részről pedig hatnak az őket termelő endokrin sejtek terület denzitására is. Méghozzá azáltal, hogy befolyásolják az egyes őssejtek és/vagy progenitor sejtek differenciálódását, és végső soron az egyes hormonok expresszióját. A normál sejtdenzitás megváltozása, átalakulása a teljes szervezetre hatással van. Úgy tűnik, hogy az étrend szerepe messze túlmutat már azon a felszínen, amit eddig megismerhettünk. Eredeti közlemény: El-Salhy, M., Mazzawi, T., Hausken, T., & Hatlebakk, J. G. (2016). Interaction between diet and gastrointestinal endocrine cells. Biomedical Reports, 4(6), 651–656. Szemlézte:Mezei Zsuzsanna eLitMed.hu 2016. szeptember
Az inzulinrezisztencia több betegség, szindróma pathogenezisében részt vesz, ezek közül a legfontosabb a metabolikus szindróma, a 2-es típusú cukorbetegség, a polycystás ovarium szindróma
A rheumatoid arthritis (RA) patomechanizmusának ismert résztvevői az aktivált T-sejtek által stimulált B-sejtek és a monocyta-macrophag rendszer sejtjei, amelyek jelentős mennyiségű gyulladásos citokint termelnek. A citokinek hatásukat a különböző sejteken megjelenő receptorok közvetítésével fejtik ki.
Klinikum
A húgysav keletkezésének vannak endogen (purinszintézis, sejtpusztulás) és exogen (táplálkozás) forrásai. A kezelésnek tehát ennek megfelelően kell, hogy legyen nem csak endogen, hanem exogen útja is, ami magát a táplálkozást (és a helyes életvitelt is) foglalja magába.
Gyulladásos bélbetegség esetén több mint duplájára nő a demencia kockázata; IBD-ben szenvedőknél 7 évvel korábban kezdődik az elbutulás.
Mint az akkor a kutatásszervező Ventavia Research Group alkalmazásában álló regionális igazgató a The BMJ-nek elmondta, a Ventavia adatokat hamisított, nem maszkolt/nem vak módon kezelte a betegeket, nem megfelelően képzett vakcinátorokat alkalmazott, és a III. fázisú vizsgálatok során nem követte megfelelően a betegek által jelentett adverz eseményeket. A cég minőség-ellenőrzéssel foglalkozó munkatársai olyan sok problémát találtak, aminek megoldására képtelenek voltak. Miután a Ventavia vezetését a regionális igazgató, Brook Jackson többször is tájékoztatta a problémákról, az FDA-nak is panaszos e-mailt írt – a Ventavia még aznap kirúgta.
Ökológia
A gyógyszergyárak gyakorlatát számos magas színvonalú kritika érte az elmúlt évtizedben, ezzel szemben a Big Ag viszonylag kevesebb figyelmet kapott orvostudományi folyóiratokban. Számos betegséggel összefüggésbe állítható a táplálkozás. Jelentőségénél fogva hasonlóan kiemelt szakmai figyelmet érdemelne.
A karanténhoz társuló stressz alvászavarokat is okozhat, ami tovább fokozhatja a stresszt és ezáltal a táplálékbevitelt, ami egy ördögi kör kialakulásához vezethet. Fontos, hogy vacsorára olyan ételeket fogyasszunk, amelyek szerotonint vagy melatonint tartalmaznak vagy elősegítik ezeknek a szintézisét.
Számos súlyos egészségügyi probléma kiváltó okai az iparosított élelmiszer- és mezőgazdasági rendszerekben keresendők – írják a The potential of diversified agroecological systems to deliver healthy outcomes: Making the link between agriculture, food systems & health című, Food Policy szaklapban megjelent tanulmány szerzői. A nagymértékben külső inputokra utalt mezőgazdaság, az intenzív állattartás, az erősen feldolgozott élelmiszerek kiterjedt marketingje és a deregulált globális kereskedelmi láncok mind példaként sorolhatók fel erre. Általában mégis a tágabb kontextus figyelembevétele nélkül, úgy tekintenek a különféle egészségügyi problémákra, mintha azok minden mástól függetlenül lépnének fel. A túlsúlyt például gyakran egyéni életmódbeli választások kérdéseként tárgyalják (az étrendre és a mozgásra összpontosítva), kevés figyelmet fordítanak arra, hogy mi a kapcsolata az „élelmiszer-környezet” (food environment) egyéni döntésekre gyakorolt hatásával. További példa az élelmiszer eredetű megbetegedések esete. Miközben a szakértők jellemzően a hosszú élelmiszer-ellátási láncok átláthatatlanságát és az intenzív állattartást jelölik meg ezek kiváltó okaiként, szélesebb körben leginkább pusztán közegészségügyi krízisként tekintenek rájuk.
Több zöldséget, gyümölcsöt, rostot, mogyorófélét, magokat és telített zsírokban szegény fehérjéket lenne fontos fogyasztani. Erősen csökkenteni kell a hozzáadott cukor, a cukros rágcsálni- és innivalók, a túlzott só és a feldolgozott húsok bevitelét,
1.
2.
3.
Ideggyógyászati Szemle Proceedings
Egészségügyi szakmai irányelv az akut ischaemiás stroke diagnosztikájáról és kezeléséről4.
5.
1.
2.
Klinikai Onkológia
A rosszindulatú daganatok fenotípusának plaszticitása és az immunogén mimikri3.
Klinikai Onkológia
A szarkopénia mérése komputertomográfiával és jelentősége az onkológiai betegeknél4.
5.
HOZZÁSZÓLÁSOK
0 hozzászólás